Portrait général de la réponse immunitaire induite par le SARS-CoV-2

TRIBUNE — Décrire le système immunitaire et son mode de fonctionnement nécessite d’y consacrer un ouvrage entier, et même une vie entière, tant ce domaine, complexe, évolue. Depuis le début des années 2000, les découvertes explosent et cela s’est accéléré avec la pandémie du SARS-CoV-2. Il est cependant possible de présenter succinctement les principaux éléments qui interviennent dans la pathologie infectieuse, le Covid-19, ou faisant suite aux injections anti-covid, afin de cerner au mieux les mécanismes qui y sont impliqués.
Introduction : présentation du système immunitaire
Globalement, le système immunitaire a pour objectif d’assurer la protection et l’intégrité du corps humain à l’encontre d’éléments potentiellement nocifs, voire mortels. Pour réaliser cette mission, il va devoir :
- empêcher les pathogènes d’entrer dans l’organisme,
- les reconnaître spécifiquement pour éviter de tuer les cellules saines constitutives de l’organisme qu’il défend, ce qui équivaut à faire la différence entre le « soi » (ce qui appartient à l’organisme) du « non-soi » (ce qui n’appartient pas à l’organisme),
- isoler puis détruire les perturbateurs.
Il y a donc :
- des mécanismes de reconnaissance,
- des mécanismes de défenses,
- des mécanismes d’attaques.
Par définition, le système immunitaire est l’ensemble des facteurs humoraux, c’est-à-dire solubles et cellulaires dont la principale fonction consiste à défendre l’organisme contre les éléments pathogènes.
Sans entrer dans les détails, les facteurs humoraux sont constitués d’un groupe hétérogène de molécules. En effet, on peut y inclure :
- Les cytokines, des messagers chimiques permettant aux cellules de communiquer entre elles, de stimuler leur renouvellement et d’orienter la réponse immunitaire pour gagner en efficacité contre le pathogène,
- Les peptides antimicrobiens, une grande famille de molécules qui possèdent diverses propriétés anti-infectieuses,
- Les molécules du complément, un groupe de protéines présentes dans le plasma sanguin, impliquées dans la destruction directe ou indirecte de pathogènes et pouvant alerter le système immunitaire,
- Les anticorps, des glycoprotéines produites par les plasmocytes, c’est-à-dire les lymphocytes B activés, et dont le rôle est beaucoup plus complexe que la simple immobilisation des agents nocifs.
Cela fait un peu catalogue mais, chaque élément contribue à la défense de l’organisme et joue un ou plusieurs rôles dans la réponse immunitaire.
Les éléments cellulaires sont répertoriés en deux catégories :
- Les cellules appartenant à l’immunité « innée », c’est-à-dire l’immunité immédiate et non spécifique à un microorganisme donné.
- Les cellules constituant l’immunité « adaptative », c’est-à-dire l’immunité plus tardive et dont l’activité cible spécifiquement le pathogène à l’origine du déclenchement de la réponse immune.
Avant de décrire les différents types cellulaires, il est toutefois bon de préciser que la frontière entre immunité « innée » et « adaptative » est loin d’être franche. En effet, ces deux pans du système immunitaire se complémentent et bon nombre d’effecteurs cellulaires et moléculaires se retrouvent à l’interface entre les réponses « innée » et « adaptative ».
Pour compliquer l’affaire, en immunologie (et en biologie plus largement), il existe pléthore de synonymes ou de dénominations différentes pour désigner un élément. Le jargon peut être particulièrement difficile à maîtriser pour des non-initiés, car l’utilisation de tel ou tel terme dépend du degré de précision que les scientifiques veulent apporter à leurs explications.
Par exemple, un anticorps peut être indiqué sous le terme d’ « immunoglobuline » ou par le sigle « Ig ». Cependant, le terme « immunoglobuline » seul est insuffisant pour désigner spécifiquement un anticorps. En effet, les molécules du complexe majeur d’histocompatibilité (CMH) appartiennent aussi aux immunoglobulines, tout comme certains récepteurs de cytokines. En résumé, le terme « immunoglobuline » désigne une famille de molécules à laquelle appartiennent les anticorps. Restreindre les immunoglobulines aux anticorps est une erreur.
Pour en revenir au problème de la terminologie, tout dépend du contexte dans lequel le vocabulaire est employé, et du degré de subtilité apporté par l’auteur… Pour tenir compte de cette difficulté, les différentes appellations d’une même population cellulaire seront stipulées en groupements.
Ces différents groupements pour les cellules de l’immunité innée sont :
- les monocytes, les macrophages et les cellules dendritiques qui constituent la lignée monocytaire,
- les polynucléaires (aussi appelés granulocytes) comportent les neutrophiles, les basophiles, les mastocytes et les éosinophiles. Ces cellules constituent la lignée granulocytaire,
- les « natural killer », encore appelés simplement les NK.
Les cellules de la lignée monocytaire ainsi que les polynucléaires neutrophiles sont des phagocytes, c’est-à-dire des cellules capables de phagocytose.
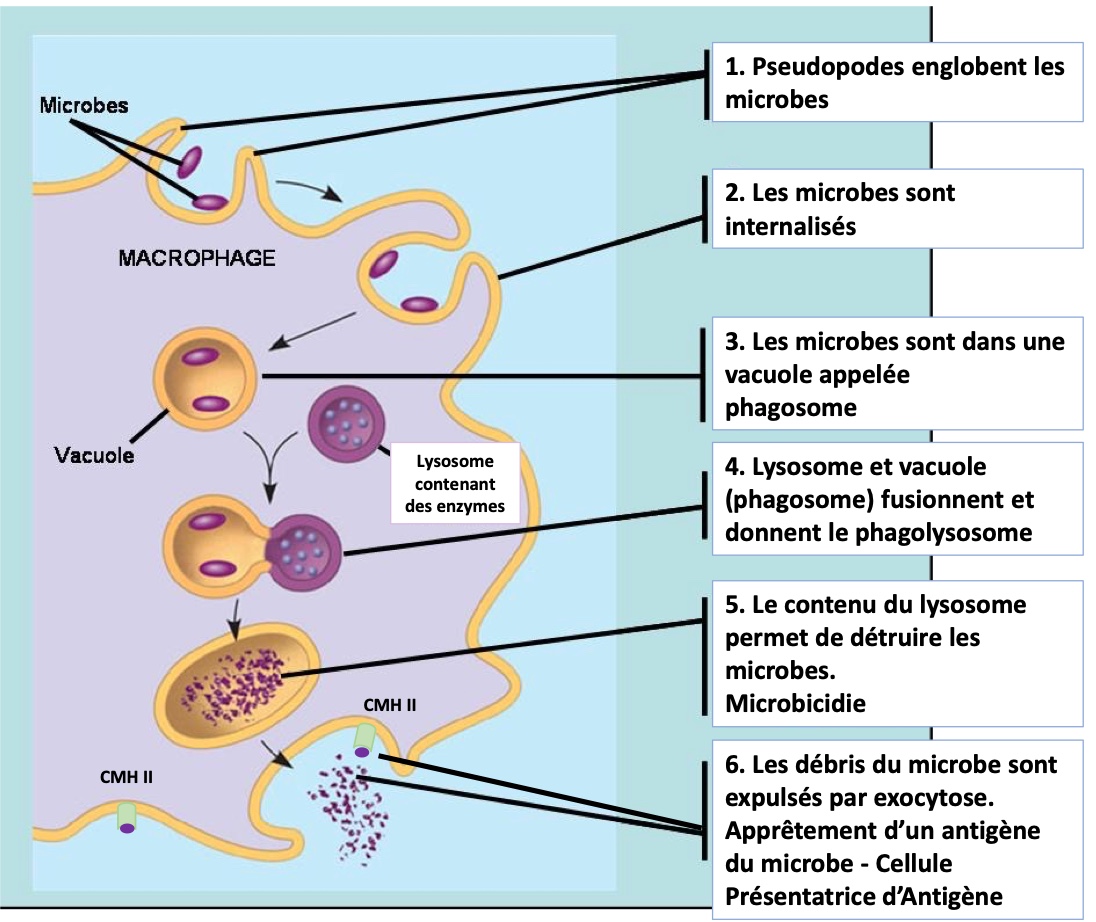
Qu’est-ce que la phagocytose ? Il s’agit d’un mécanisme cellulaire visant à détruire les agents pathogènes. Grossièrement, les phagocytes englobent les microbes et les internalisent dans des vacuoles appelées « phagosomes ». Ce mécanisme s’appelle « endocytose ». Ensuite, des vésicules appelées « lysosomes » viennent fusionner avec les phagosomes pour y libérer des enzymes et d’autres molécules capables de détruire les pathogènes endocytés. La destruction (ou lyse) des microbes s’appelle « microbicidie ». Une fois déchiquetés, les débris des pathogènes sont expulsés mais, lors de ce processus, le phagocyte récupère un petit morceau du microbe lysé, un « antigène du non-soi » pour le placer sur une molécule présentatrice, le complexe majeur d’histocompatibilité II (ou CMH II). À la fin de ce mécanisme appelé « apprêtement », le phagocyte est devenu une « cellule présentatrice d’antigène » et peut alors alerter le système immunitaire adaptatif. En effet, les cellules de l’immunité « adaptative » peuvent reconnaître le complexe « CMH II-antigène du non-soi » et s’activer de façon spécifique.
Quelques explications rapides concernant les CMH… Ces molécules sont des marqueurs de l’identité moléculaire des cellules. En somme, elles sont impliquées dans les mécanismes de reconnaissance du « soi » et du « non-soi » par les cellules de l’immunité. Le CMH I est ubiquitaire, présent à la surface de toutes les cellules nucléées de l’organisme, et, associé à un antigène du « soi » - un antigène issu du métabolisme normal des cellules, il représente une sorte de « carte d’identité moléculaire » des cellules. Les cellules immunitaires ne reconnaissent pas ce complexe et elles sont dites tolérantes au soi. En cas de modification de l’antigène porté par le CMH I, en cas de cancer ou d’infection virale par exemples, les cellules immunitaires vont s’activer et détruire la cellule qui présente alors un antigène du « soi modifié » (anormal donc) ou un antigène du « non-soi ». Le CMH II est exprimé par certaines cellules de l’immunité, surtout les CPA. Son rôle consiste à présenter un antigène du « non-soi » lors de la mise en place de la réponse immunitaire adaptative, c’est-à-dire lors de l’activation des lymphocytes.
Les basophiles, ou les mastocytes – en réalité des basophiles tissulaires, ainsi que les éosinophiles sont impliqués dans les réponses immunitaires plus spécialisées comme les réponses allergiques ou les réponses antiparasitaires. Cependant, ces cellules jouent un rôle non négligeable dans la réponse immunitaire induite par le SARS-CoV2.
En ce qui concerne l’immunité adaptative, les cellules sont :
- les lymphocytes B, ou LB, support de la réponse immunitaire humorale avec la production d’anticorps,
- les lymphocytes T, ou LT, constitués de plusieurs sous-populations et dont les rôles dans la réponse immunitaire sont spécifiques.
Pour faire simple, les LT sont subdivisés en :
- LT CD4+ - appelés LT helper ou LT auxiliaire,
- LT CD8+ - les cytotoxiques,
- LTreg ou Treg – les « extincteurs » de la réponse immunitaire et préviennent l’apparition des maladies auto-immunes.
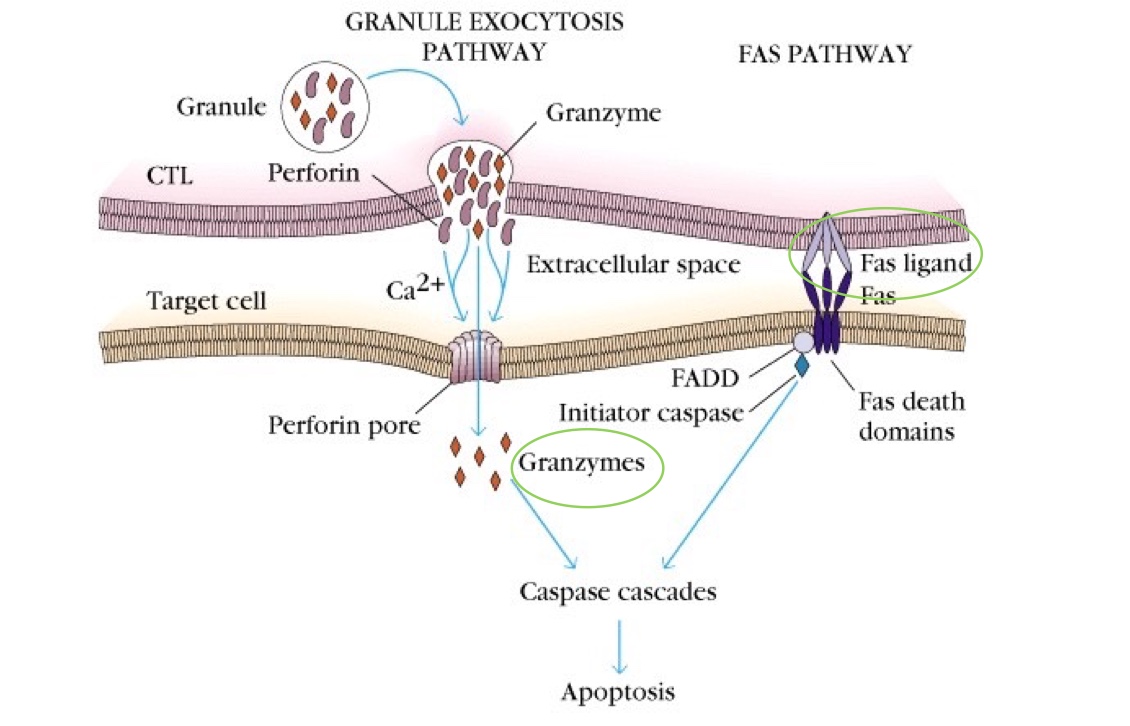
Les LT CD8+ possèdent une activité lytique directe par activation de son TCR ou T-cells receptor. Les TCR sont des récepteurs membranaires caractéristiques des lymphocytes T. Ils procurent aux LT la propriété de reconnaître des fragments peptidiques antigéniques associés aux molécules du CMH et ceci de manière spécifique. En effet, les TCR des LT CD8+ s’activent au contact d’un CMH I d’une cellule présentant un antigène du « non-soi ». Ensuite, le lymphocyte T CD8+ enclenche son processus cytolytique : il s’accole à sa cellule cible, libère des perforines qui trouent sa membrane plasmique et des granzymes qui induisent son apoptose, c’est-à-dire sa mort. Le LT CD8+ possède aussi le Fas-ligand qui induit aussi la voie apoptotique de sa cellule cible. En somme, non seulement le LT CD8+ détériore la membrane plasmique de la cellule cible mais, en plus, il la pousse à se suicider (cf. schéma ci-dessous).
Pour finir, le LT CD8+ produit des cytokines comme l’interleukine-2 (IL-2), l’IFNγ et le TNF (tumor necrosis factor) pour maintenir la cytotoxicité et activer les macrophages, les lymphocytes B (LB) et les NK. Il est à noter que les NK agissent comme les LT CD8+.
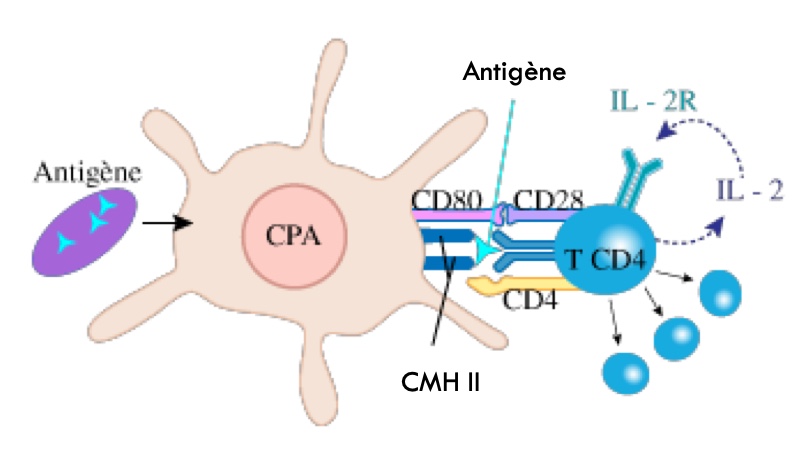
Les LT CD4+ possèdent aussi un TCR mais ce dernier s’active au contact d’un complexe [CMH II/antigène du « non soi »], généralement présent au niveau des CPA (cf. mécanisme de la phagocytose).
Pour résumer, l’objectif de cette interaction LT CD4+/CPA est d’orienter la réponse immunitaire adaptative de façon spécifique au pathogène rencontré.
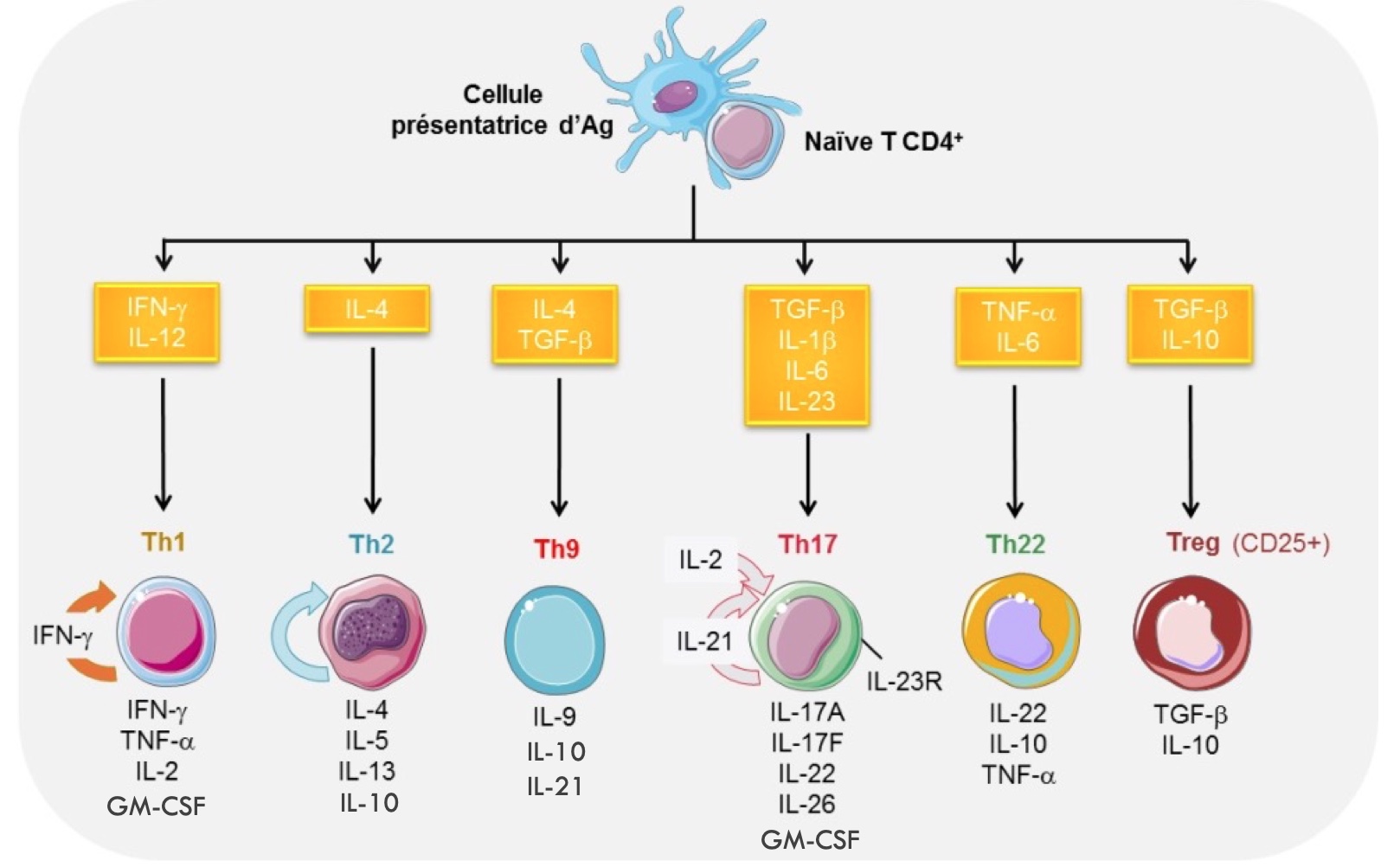
En effet, le LT CD4+, aussi appelé LT helper ou auxiliaire, se différencie en un phénotype dit « Thx », où x est le numéro de la voie immunitaire permettant de lutter contre le pathogène. Il se met alors à produire des cytokines pour stimuler et soutenir certaines cellules immunitaires, selon le type de réponse à apporter pour éliminer l’agent nocif.
Il produit d’abord de l’IL-2 pour proliférer.
Ensuite, il sécrète différents cocktails de médiateurs pour activer les autres populations lymphocytaires (cf. schéma ci-dessous). L’une de ces voies est appelée Th1 et elle correspond à une activation des LT CD8+ décrite ci-dessus, avec les mêmes modalités d’action. La voie Th2 correspond à une activation des lymphocytes B avec la production d’anticorps.
Bien entendu, il existe d’autres voies d’activation : Th17, Th22, Th9 et Treg. Pour faciliter la lecture de ce papier, les explications concernant ces autres voies sont incluses dans les paragraphes suivants.
Les lymphocytes B ou LB représentent environ 12% des lymphocytes et sont impliqués dans la production d’anticorps à la suite de leur activation et différenciation en plasmocytes. Cette différenciation est médiée par les LT CD4+ différenciés en Th2 mais les LB peuvent aussi répondre directement à des antigènes peptidiques, glucidiques ou glycolipidiques grâce à leur BCR (« B Cells Receptor »).
Comme le TCR, le BCR est un récepteur membranaire, mais il est similaire à un anticorps. En reconnaissant directement l’antigène, le LB se transforme en plasmocyte producteur d’anticorps capables de se fixer sur l’antigène inducteur. Seulement, les anticorps produits à cette occasion sont de faible affinité et les plasmocytes sont de courte durée de vie (quelques jours). Cette production est toutefois nécessaire, octroyant ainsi le temps à d’autres LB de maturer dans les centres germinatifs et produire des anticorps de haute affinité.
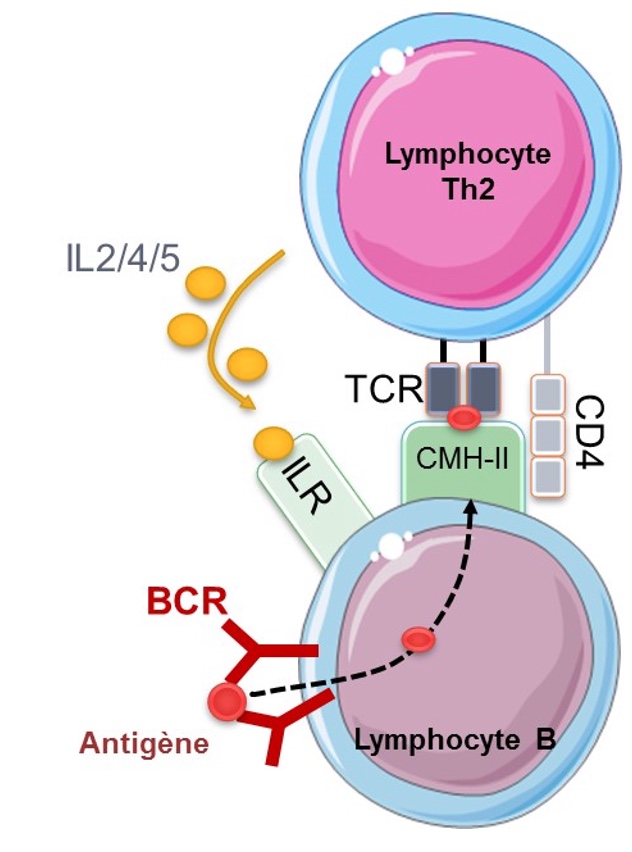
La maturation dans les centres germinatifs peut s’effectuer à l’aide des Th2 et des lymphocytes folliculaires helpers (Tfh).
Cette maturation est dite « T-dépendante » et elle permet :
- d’augmenter l’activation des LB,
- d’activer la prolifération des LB,
- d’améliorer l’affinité entre anticorps et antigène grâce à la recombinaison des certains gènes (VDJ notamment)
- la mise en mémoire de cellules immunitaires dans la moelle osseuse. Celle-ci est conditionnée par l’affinité de l’anticorps pour l’antigène et la résistance à l’apoptose.
Les anticorps peuvent être présents :
- sous forme soluble dans le plasma (γ-globulines plasmatiques) et dans de nombreuses sécrétions (sucs et mucus),
- sous forme membranaire comme élément « récepteur » de l’antigène (Ag) à la surface des cellules B (BCR) (cf. ci-dessus)
Un anticorps est formé de deux chaînes lourdes (μ, γ, δ, α ou ε) et de deux chaînes légères (κ ou λ), formant une structure en forme de Y. Les chaînes sont liées entre elles par des ponts disulfures et il est possible de repérer 2 parties : une partie dite « variable » contenant le paratope impliqué dans la reconnaissance de l’antigène et une partie dite « constante » qui possède aussi des fonctions biologiques. (cf. schéma ci-dessous)
Vu la très grande diversité des antigènes, le paratope possède ce qu’on appelle des « régions hypervariables » ou « HVR ». Ces domaines sont également appelés « CDR » pour « Complementarity Determining Regions ». La liaison anticorps-antigène s’effectue par complémentarité de forme grâce aux CDR. La diversité des régions HVR ou CDR est due à la recombinaison génétique, notamment la recombinaison VDJ déjà mentionnée, lors de la maturation des lymphocytes B. Ce système de remaniement, appelé hypermutation somatique, permet de synthétiser des millions et des millions d’anticorps différents. Néanmoins, chaque lymphocyte B produit un seul type d’anticorps, une fois le remaniement génétique fait (en excluant la commutation de classe).
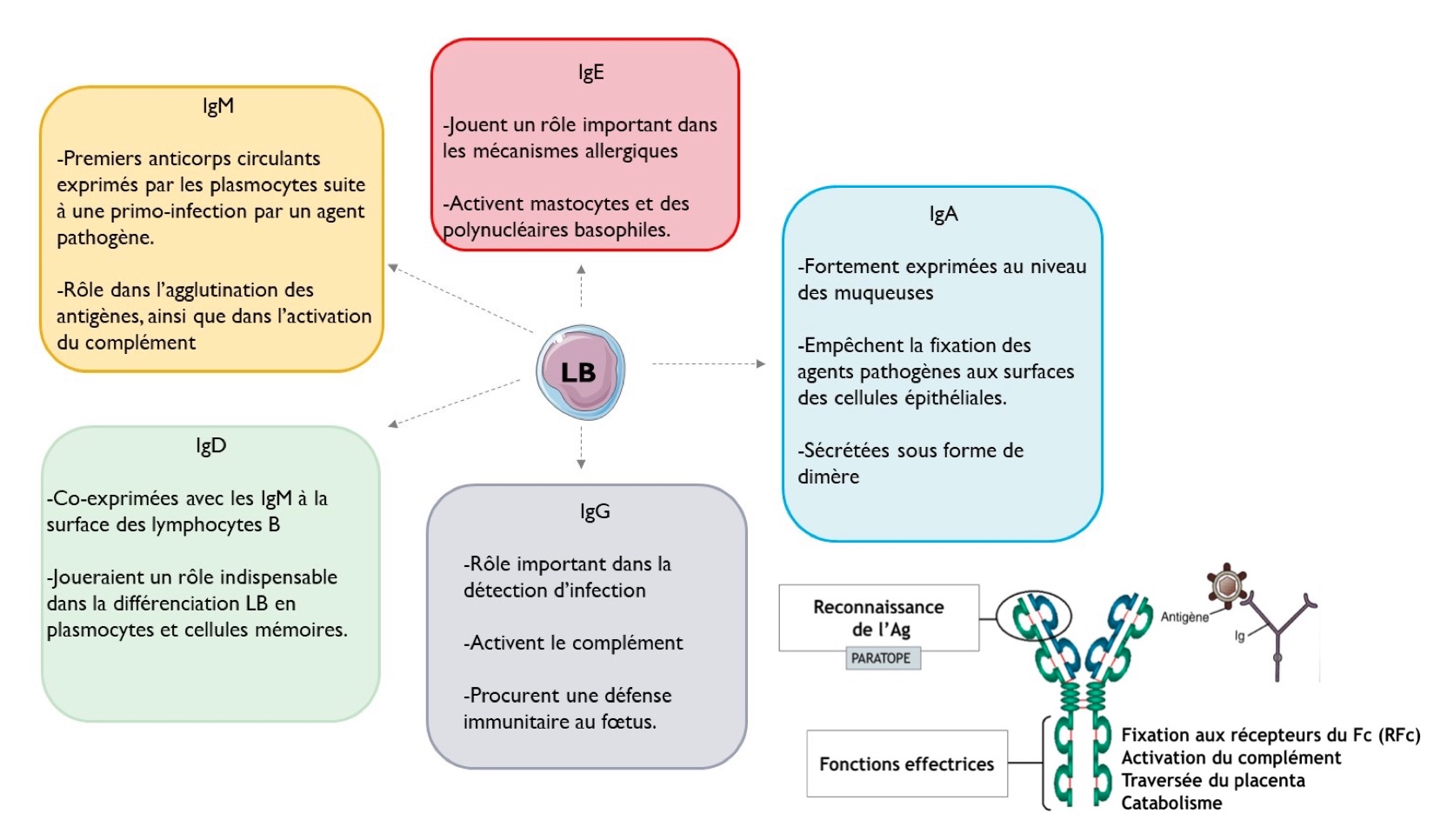
Il existe globalement 5 classes d’anticorps différents selon le type de chaîne lourde qui forme les anticorps. On retrouve classiquement :
- IgG (chaîne lourde γ) - 150 kDa; 75 % des Ig sériques (env 12 g/L)
- IgA (chaîne lourde α) -160 kDa; 10 à 15% des Ig circulantes (env 2g/L)
- IgM (chaîne lourde µ) - 5 à 10 % des Ig sériques (1 à 1,5 g/L)
- IgD (chaîne lourde δ) - 175 kDa; concentration sérique seulement 30mg/L, Ig de surface essentiellement
- IgE (chaîne lourde ε) - 190 kDa; la plus faiblement représentée dans le sérum (0,1 mg/L)
En fonction de leur classe, les anticorps ont une activité particulière et certains présentent des structures spéciales… En effet, les IgM et les IgA possèdent une chaîne de jonction J qui assure la cohésion des polymères. Les IgA présentent en plus une pièce sécrétoire S. Ce sont des anticorps sécrétés au niveau des muqueuses et qui sont fondamentaux pour en assurer la protection contre des pathogènes.
Cette partie introductive est certes longue et complexe. Mais, elle est nécessaire à la bonne compréhension des mécanismes décrits ci-dessous.
Source : « Immunologie » de Janis Kuby, Owen J.A., Punt J., Stranfort S.A. – 7ᵉ édition, Dunod, ISBN-10 2100705431, ISBN-13 978-2100705436
La réponse immunitaire induite par le virus : un tableau immunitaire incomplet
A. La réponse immunitaire innée
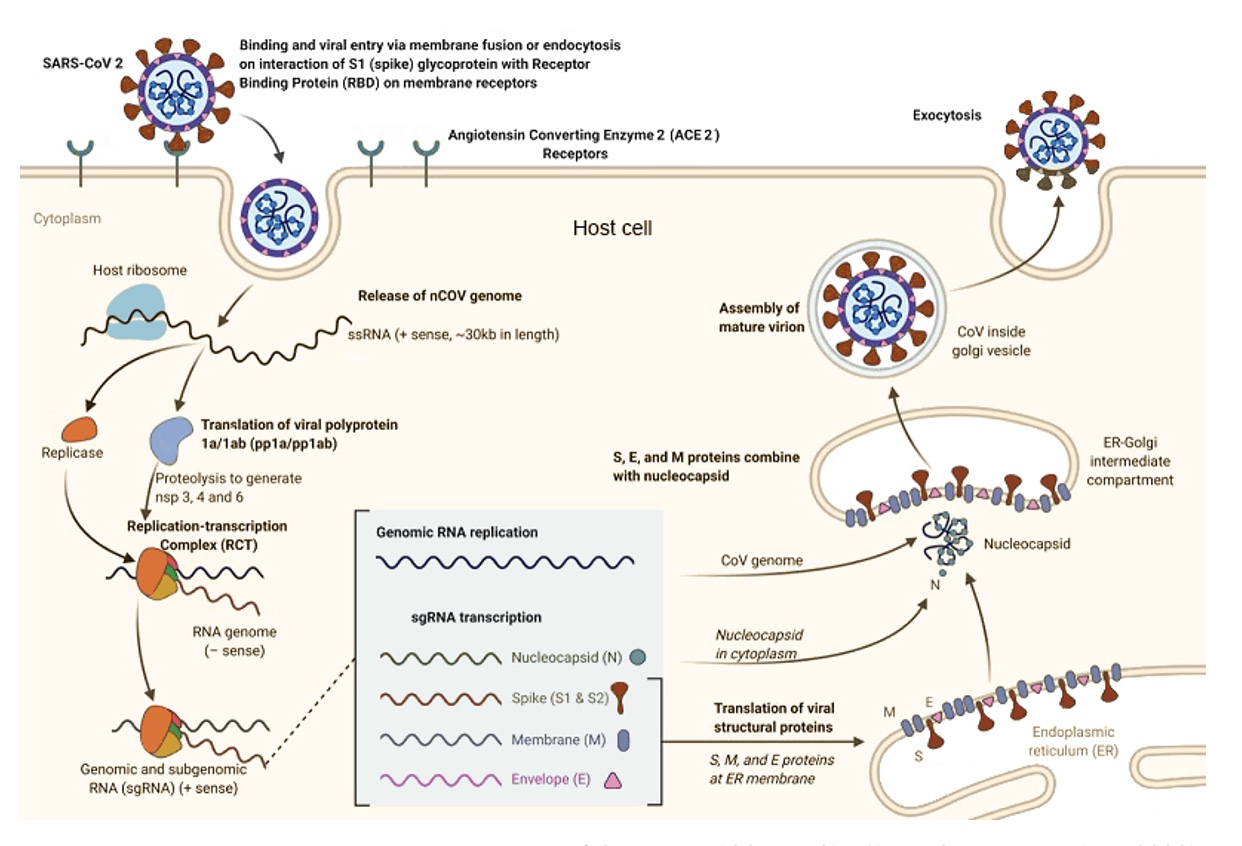
Les virus, comme le SARS-CoV2, agissent comme des parasites cellulaires. Ils ont besoin de la machinerie de la cellule pour se multiplier. Pour pénétrer dans les cellules, le SARS-CoV-2 peut utiliser différents moyens. Il peut simplement être endocyté, c’est-à-dire internalisé dans une cellule via une vésicule (Bayati, A. et al. 2021) ou utiliser des récepteurs comme la neuropilin-1 (Cantuti-Castelvetri, L. et al. 2020) ou le plus connu, le récepteur ACE2 appartenant au système rénine-angiotensine (SRA) (Hoffmann, M. et al. 2020).
D’autres molécules peuvent intervenir et faciliter la fusion du virus avec la membrane de la cellule hôte comme les lectines (Lempp F. A. et al. 2021), les héparanes sulfates (Kalra, R. S. & Kandimalla, R. 2021) ou le co-récepteur TEMPRSS2 (Hoffmann, M. et al. 2020) qui amorce l’entrée du virus via le récepteur ACE2.
Une fois dans la cellule, l’ARN viral est libéré puis décodé par les ribosomes pour produire les protéines virales, dont un complexe “réplication/transcription”. S’ensuit la production des nouveaux constituants et l’émergence de nouveaux virions.
Il faut savoir que, en général, toutes les cellules du corps humain participent à la réponse immunitaire. Elles appartiennent au système inné. Elles détectent la présence du virus grâce à la présence de « senseurs », de récepteurs, appelés PRRs – « Pattern Recognition Receptors ». Ces PRRs reconnaissent les pathogènes grâce à des motifs moléculaires très conservés appelés PAMPs – « Pathogen Associated Molecular Patterns ». Pour le SARS-CoV-2, il s’agit de l’ARN et des protéines virales, notamment la protéine Spike et les nucleocapsides (Diamond, M. S. & Kanneganti, T.-D. 2022).
Parmi les PRRs cellulaires sensibles aux constituants du SARS-CoV2, on retrouve :
- Les Toll-like Receptors (TLRs), notamment les TLR1, 2, 4, 6, le TLR3 (Totura, A. L. et al. 2015 ; Zhang, Q. et al. 2020) et TLR7 et 8 (Borghi, M.O. et al. 2020; Hurst, J et al. 2009)
- Les « retinoic acid-inducible gene I (RIG-I)- like receptors » (RLRs) comme le RIG-1, le MDA5 et le LGP2 (Diamond, M. S. & Kanneganti, T.-D. 2022)
- Les « nucleotide-binding oligomerization domain (NOD)-like receptors » ou NOD-like receptors (NLRs) (Diamond, M. S. & Kanneganti, T.-D. 2022) (cf. image ci-dessous)
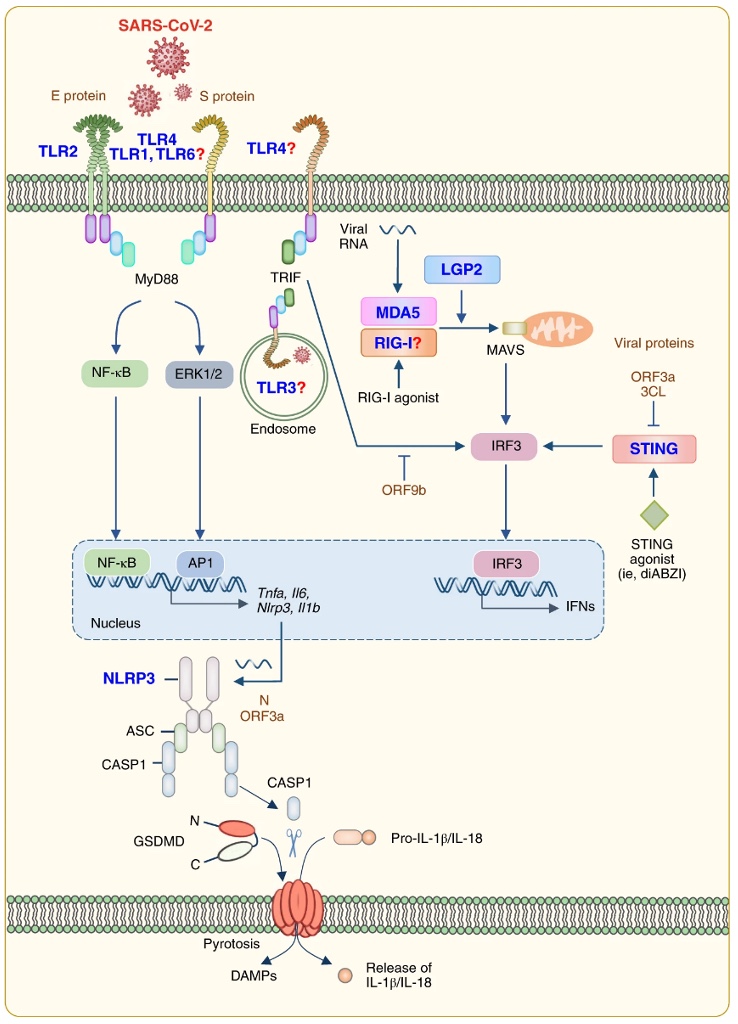
L’activation de ces récepteurs induit deux phénomènes :
1. Le déclenchement de la voie de l’interféron (IFN) - importante dans l’immunité antivirale,
2. La mise en place d’inflammasomes et le clivage de la gasdermine (GSDM), ce qui aboutit à la pyroptose, c’est-à-dire la mort de la cellule, avec libération d’IL1β, d’IL18 et de DAMPs (« Damage-associated Molecular Patterns »).
Les interférons, notamment les interférons de type I (IFNα et IFNβ), jouent un rôle important dans la réponse immunitaire antivirale. En effet, les IFN de type I sécrétés se fixent sur un récepteur et enclenchent la voie de signalisation JAK/STAT (Seneff, S. et al. 2022). Cela provoque l’expression de gènes antiviraux bloquant, par exemple, certains processus de traduction cellulaire, rendant ainsi le développement du virus au sein de la cellule difficile. Non seulement ils déclenchent un état de résistance des cellules au virus mais, en plus, ils alertent les cellules avoisinantes non contaminées et induisent la production de cytokines pour avertir le système immunitaire. (Junis Kuby, 7e édition) (Andreakos, E. et al. 2022).
Dans le cadre d’une infection médiée par le SARS-CoV-2, les interférons semblent jouer un rôle crucial pour lutter contre le virus. En effet, on sait que des personnes présentant des déficiences en TLRs, notamment les TLR3 et TLR7, sont plus sensibles au virus. La production d’interférons est plus faible chez ces personnes et elles sont donc plus susceptibles de développer des formes graves de la COVID-19 (Andreakos, E. et al. 2022). De plus, d’après la littérature, des anticorps anti-IFN ont été détectés dans plus de 10% des formes graves (Troya, J. et al. 2021) (Andreakos, E. et al.) (Zhang, Q. et al. 2020). D’ailleurs, un des mécanismes d’échappement du virus à la surveillance du système immunitaire est d’inhiber en partie la production d’IFN de type-I (Liu, G. et al. 2021) (Lei, X. et al. 2020).
À l’inverse, une expression accrue d’IFN de type I semble conférer une certaine protection à l’encontre du virus. Des personnes atteintes de lupus Pernio, une pathologie touchant essentiellement la peau, restent séronégatives bien que la présence de la protéine Spike ait été détectée dans des biopsies cutanées. Une forte réponse locale de type IFN-I fut également observée chez ces patients, suggérant une élimination rapide du virus (Colmenero, J. et al. 2020) (Andreakos, E. et al.) (Zhang, Q. et al. 2020). Pour finir, d’après l’article de Janet Chou, les enfants répondent aussi au virus par une forte production d’IFN de type I, ce qui les protège des formes graves. D’autres facteurs protecteurs y sont mentionnés comme l’expression plus faible du récepteur ACE2, ce qui entraîne une infectiosité moindre, et une production thymique plus importante, et donc un nombre de lymphocytes T opérationnels plus grand. (Chou, J. et al. 2022)
Pour en revenir aux mécanismes de la réponse immunitaire induite par le SARS, les cytokines produites, l’IL1β, l’IL-18 et les DAMPs alertent les monocytes/macrophages, les granulocytes (dont les neutrophiles) et les Natural Killer (NK) (Petter Brodin, 2021). Par ailleurs, le SARS-CoV-2 inhibe l’expression du CMH I à la surface des cellules infectées (Zhang, Y. et al. 2021). Ce mécanisme, avec les DAMPs, active les Natural Killer (NK). Ces derniers déclenchent alors leur activité cytolytique à l’encontre de la cellule infectée en libérant des perforines et des granzymes. Ainsi, la cellule infectée est éliminée, soit à la suite de la formation des inflammasomes, soit par les NK (Diamond, M. S. & Kanneganti, T.-D. 2022).
Les NK activés produisent aussi de l’IFNγ, un interféron de type II. Cette molécule permet de recruter et d’activer des phagocytes et des lymphocytes T CD8+ sur le site d’intérêt afin d’accroître la réponse immunitaire. Les LT CD8+ lysent les cellules infectées en reconnaissant directement, via leur TCR, les complexes [CMH I/antigène viral] exposés à leur surface. Les phagocytes éliminent les débris cellulaires en les phagocytant puis se transforment en CPA pour permettre la présentation d’antigènes viraux aux LT CD4+, dans les ganglions. A l’inverse, l’IL-10 joue un rôle anti-inflammatoire et calme la réponse immune. (Vivier, E. et al. 2011).
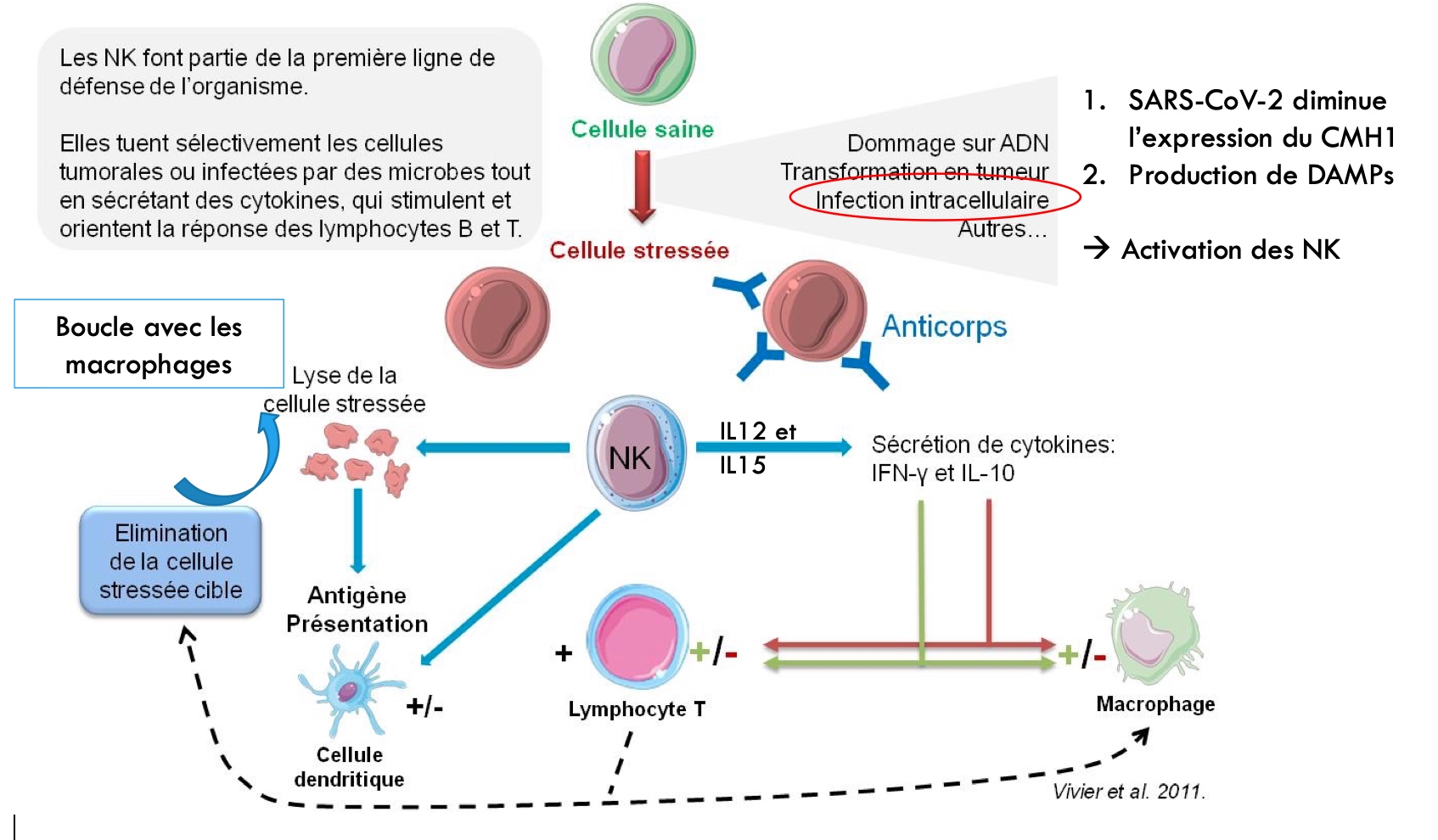
L’IFNγ attire aussi des LB sur le site d’intérêt. Ces derniers s’activent alors directement au contact des antigènes grâce aux BCR et se différencient en plasmocytes. Seulement, cette stimulation entraîne une production d’anticorps de faible affinité pour les antigènes viraux et ces cellules B n’ont qu’une courte durée de vie. Néanmoins, ce processus est favorisé dans l’ADCC (« Antibodies dependant cell-cytotoxicity »), afin de soutenir l’activité cytolytique des NK - cf. schéma ci-dessus (Jacob, J et al. 1991) (Bonaud Amélie, thèse de 2015) (Janis Kuby, 7ᵉ édition). Les plasmocytes produisent alors des IgM et des IgG à l’encontre des antigènes viraux dont la protéine Spike (anticorps anti-S) (Kim, S. D. et al. 2020) (Hasan, A. et al. 2021).
Autre point d’intérêt, les plasmocytes produisant des anticorps de type IgA, essentiels à la protection des muqueuses, migrent des ganglions vers ces tissus grâce à l’IFNγ et s’activent via leurs BCR (Cerutti, A. et Rescigno, M. 2008). Il est à noter que l’IFNγ enclenche plutôt une réponse immunitaire à médiation cellulaire, nommée Th1, avec l’activation de LT CD8+, des NK et des phagocytes. Parmi les phagocytes, il y a des neutrophiles. Ces derniers vont soutenir la synthèse d’IgA par les plasmocytes en produisant un facteur d’intérêt : APRIL. En synergie avec le TGFβ libéré par les macrophages (Wahl, S.M. et al. 1990), APRIL induit chez les plasmocytes un signal permettant la commutation de classe des anticorps en IgA (Cerutti, A. et Rescigno, M. 2008) (Thèse Amélie Bonaud 2015).
Il est à noter que les IgA peuvent aussi contribuer au phénomène ADCC mais en activant préférentiellement les neutrophiles. Il semble d’ailleurs que ces anticorps offrent des perspectives intéressantes dans le traitement des cancers et des pathologies infectieuses. (Davis, S. K. et al. 2020)
Cependant, l’activation des neutrophiles ainsi que l’IFNγ peuvent avoir de lourdes conséquences. En effet, les neutrophiles peuvent induire un phénomène appelé NETosis (« Neutrophils extracellular trap » pour NETs). Sans entrer dans les détails, les neutrophiles peuvent libérer des fibres composées d’ADN et de protéines dont la principale fonction est de piéger les pathogènes comme ceux impliqués dans les pathologies infectieuses respiratoires. Cependant, les NETs peuvent contribuer à l’hyper-inflammation et causer des dégâts au niveau vasculaire ou des micro-thromboses (Hasan, A. et al. 2021). Quant à l’IFNγ, en synergie avec le TNF, il peut induire un phénomène de PANoptose, sorte de destruction massive de cellules, qui accroît la libération de cytokines pro-inflammatoires. Cela aboutit à la formation d’une tempête cytokinique et la défaillance des organes (Diamond, M. S. & Kanneganti, T.-D. 2022).
En ce qui concerne la physiologie du SARS-CoV-2 et l’implication du récepteur ACE2 dans l’aggravation de la pathologie, le Dr Jean-Marc Sabatier a réalisé un travail pédagogique impressionnant dans plusieurs articles parus chez France Soir.
Voir aussi :
Les effets délétères associés au virus SARS-CoV-2 ou induits par les vaccins: Jean-Marc SabatierVaccination des enfants, rappels et maladies auto-immunes : analyse de Jean-Marc Sabatier
Enfin, les phagocytes devenus CPA migrent vers les ganglions lymphatiques pour :
- stimuler et activer les plasmocytes,
- enclencher une réponse immunitaire adaptative plus spécifique.
La réponse immunitaire adaptative est plus longue à initier que la réponse innée décrite jusqu’à présent.
B. La réponse immunitaire adaptative
Il est déjà acté que la réponse immunitaire adaptative est plutôt orientée vers une Th1 avec activation des LT CD8+. Cette réponse permet de développer des lymphocytes T mémoires. Toutefois, ces LT CD8+ mémoire sont insuffisants pour protéger l’organisme d’une nouvelle contamination par le SARS-CoV-2 (Kim, S. D. et al. 2020) (Paul Moss, 2022).
De façon intrigante, une lymphopénie était observée dans 63% des cas sévères de la Covid-19 (Tan, L. et al. 2020) (Lucas, C. et al. 2020). Bien que ce phénomène soit encore peu expliqué, plusieurs mécanismes semblent y être impliqués. Le premier est, semble-t-il, l’interaction de la protéine Spike avec un récepteur lymphocytaire : le CD147 (Helal, M.A. et al. 2020). Ce récepteur est fortement exprimé par les lymphocytes T activés. Le virus peut donc potentiellement infecter ces cellules immunitaires et induire leur apoptose. Bien que cette interaction ait été étudiée par modélisation moléculaire essentiellement, elle peut expliquer l’intérêt de l’hydroxychloroquine. En effet, le CD147 est aussi présent à la surface des globules rouges et il est utilisé par le Plasmodium falciparum, le parasite responsable de la malaria, pour coloniser les globules rouges (Konozy, E.H.E. 2021). Or, l’hydroxychloroquine est un traitement anti-paludisme reconnu depuis de nombreuses années. Des auteurs suggèrent aussi que l’azithromycine bloque ce récepteur, le CD147, ce qui a pour effet de diminuer la charge virale du SARS-CoV-2, de limiter la lymphopénie et donc, d’éviter les formes graves (Ulrich, H. &. Pillat, M.M, 2020).
La lymphopénie peut aussi être consécutive à l’activation de certains neutrophiles. En dehors du NETosis précédemment décrit, il existe une catégorie de neutrophiles aux propriétés immunosuppressives : les G-MDSCs (« granulocytic myeloid-derived suppressor cells »). Cette catégorie de neutrophiles possède la capacité de limiter l’expansion clonale des LT CD4+ et des LT CD8+ en libérant des substances comme l’arginase-1, des radicaux oxygénés, de l’IL-10, du TGFβ ou des prostaglandines. Ensemble, ces facteurs inhibent la prolifération des lymphocytes actifs, mais promeuvent l’expansion des lymphocytes Treg. L’une des pistes ayant ouvert la voie à l’exploration des neutrophiles est le taux d’IL-10 dans les prélèvements de personnes souffrant d’une forme grave du coronavirus. En effet, la production de cette cytokine est un marqueur prédictif de la sévérité de la pathologie. De plus, les neutrophiles représentent environ 50% des cellules dans les échantillons obtenus par lavage bronchoalvéolaire des patients infectés par le SARS-CoV-2. Des études ont démontré l’expansion des neutrophiles G-MDSCs chez les personnes sévèrement touchées par le virus, cette prolifération ayant été également associée à la lymphopénie (Hernán F. Peñaloza et al. 2021).
Enfin, il semble que les lymphocytes subissent une mort cellulaire plus ou moins directe. En effet, grâce à ses propriétés de fusion, la protéine Spike du virus est capable de créer des syncytiums cellulaires. Il s’agit de structures constituées de plusieurs cellules, une cellule internalisant plusieurs lymphocytes. Bien entendu, les cellules dedans la structure sont lysées, d’où la lymphopénie (Zhang, Z. et al. 2021). En outre, l’apoptose des lymphocytes, c’est-à-dire la mort des LT, peut être induite directement par le système Fas/Fas Ligand (FasL). Les lymphocytes T activés, notamment les Th1 et les LT CD8+, possèdent un autre récepteur membranaire : le CD95, appelé également Fas. Stimulé par le FasL, le CD95 induit une signalisation aboutissant à la destruction du lymphocyte. Bien que la production du FasL soit hautement régulée du fait de sa cytotoxicité, il semble que ses taux plasmatiques augmentent considérablement avec le degré de sévérité de la pathologie infectieuse (André, S. et al. 2022).
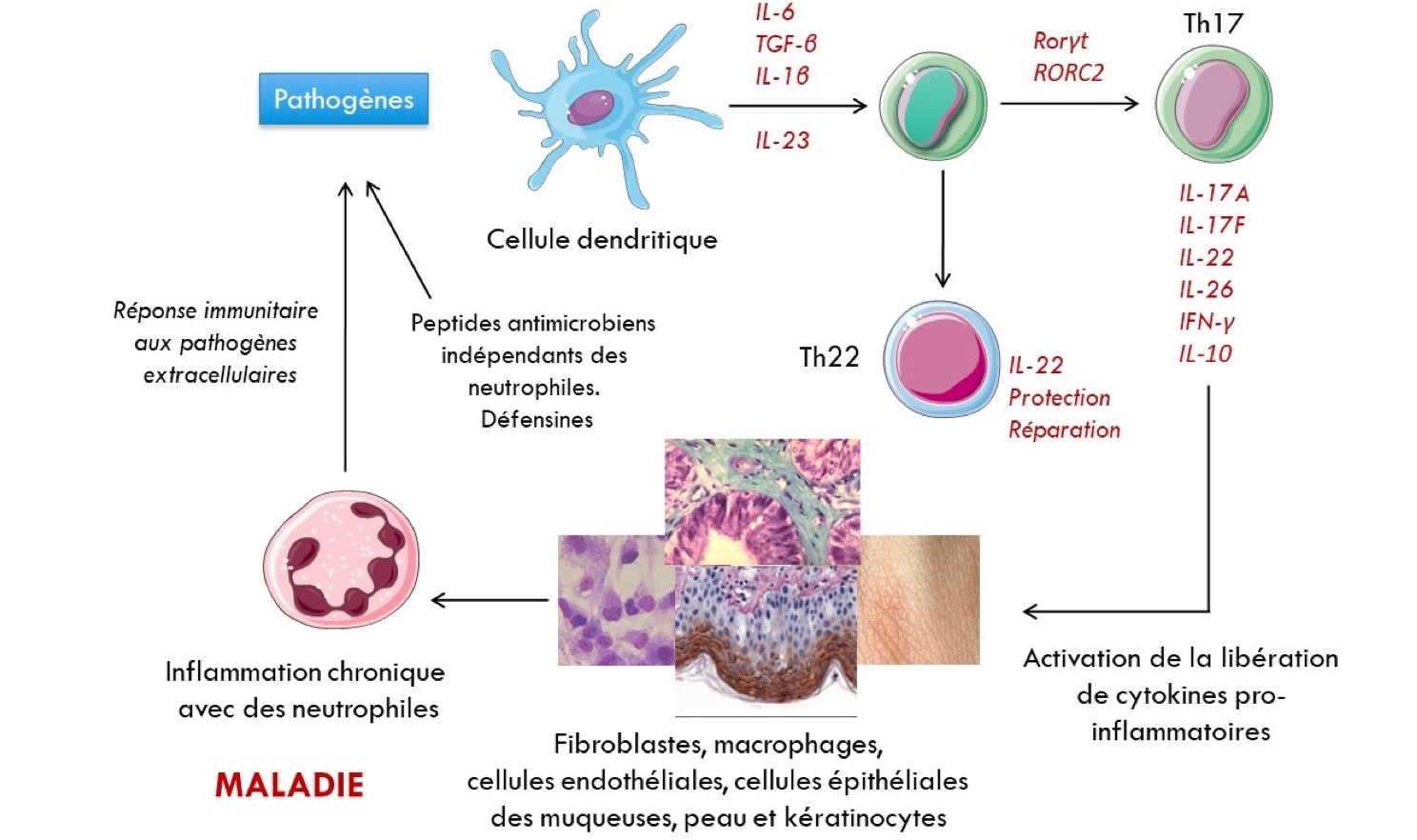
Par ailleurs, une voie Th17 a été mise en évidence dans la pathologie du SARS-CoV-2, notamment dans les formes sévères. En effet, cette voie ne semble pas activée chez les patients en état de convalescence. La différenciation des LT CD4+ en Th17 est induite par un cocktail de cytokines : IL-6 et TGFβ. Ces deux médiateurs stimulent les facteurs de transcription RORγt , RORα et STAT3, ce qui aboutit à la production d’IL-21, d’IL-22, d’IL-17A et d’IL-17F. Non seulement l’IL-17 est l’une des cytokines intervenant dans les tempêtes cytokiniques, mais elle pousse les lymphocytes à prendre un phénotype Tc17. Ces derniers dérivent des cellules cytotoxiques, mais cette fonction est plutôt inhibée au profit de la production des cytokines précitées. L’IL-17 ainsi produite (Th17 et Tc17) attire les neutrophiles et les monocytes sur le site infecté et induit la production d’IL-6 et de G-CSF, ce qui promeut l’inflammation par recrutement et activation des cellules innées. Il est à noter que ce phénomène peut être accentué par la production d’IL-17 par les neutrophiles. Or, ces derniers peuvent déclencher le phénomène de NETosis précédemment décrit. (Martonik, D. et al. 2021) (Cagan, E. et al. 2022) (McGeachy et al. 2019). Chose importante, l’IL-21 et l’IL-23 contribuent à la mise en place d’une réponse Th17 délétère alors que l’IFNγ, l’IL-2 et l’IL-4 inhibe le processus. Il semble donc que la balance Th1, plutôt bénéfique, et Th17, plutôt maléfique, soit un des mécanismes à l’origine de l’aggravation de la covid. (Martonik, D. et al. 2021)
Autre mécanisme décrit : une diminution du taux de Treg. Ces lymphocytes produisent des cytokines anti-inflammatoires comme l’IL-10 et permettent de modérer la réponse immunitaire. Or, dans les covids sévères, les patients présentent un ratio Treg/Th17 relativement bas, ce qui indique une déficience dans la régulation.
Pour finir, l’IL-22 produite permet, normalement, d’induire la voie Th22. Plutôt réparatrice, l’IL-22 stimule les fibroblastes et les cellules épithéliales pour favoriser les mécanismes de réparation. Cependant, cette cytokine semble être aussi associée dans l’inflammation pulmonaire aigue induite par du LPS (une molécule d’origine bactérienne). (Martonik, D. et al. 2021) (Sakaguchi, R. et al. 2015).
La voie Th2 semble tendancieuse. En effet, il y a peu d’éléments de réponses concernant une éventuelle maturation des lymphocytes dans les centres germinatifs. Tout ce que l’on sait, c’est qu’il y existe une production d’IgM, d’IgG et d’IgA lors de l’infection et que leurs concentrations augmentent avec le degré de sévérité de l’infection (Zheng, J. et al. 2021). Mais, les taux d’anticorps diminuent progressivement au fil du temps, notamment les anticorps anti-Spike, ce qui serait cohérent avec un mécanisme ADCC (Kim, S. D. et al. 2020).
Une production d’anticorps peut aussi être déclenchée via l’IL-21 dans la Th17, mais elle semble plutôt associée à des pathologies auto-immunes. La présence d’IL-21 a été mise en évidence dans ce type de maladies comme le lupus érythémateux, le diabète ou le psoriasis. Pour finir, dans l’article de Diana Martonik, les auteurs suggèrent une altération de la voie Th2 mais, ils oublient que la voie Th9 est activée dans un contexte Th2-like, via un cocktail de cytokines IL-4/TGFβ (Martonik, D. et al. 2021) (Kaplan, M. H. et al. 2015).
Vers une voie Th9 ?
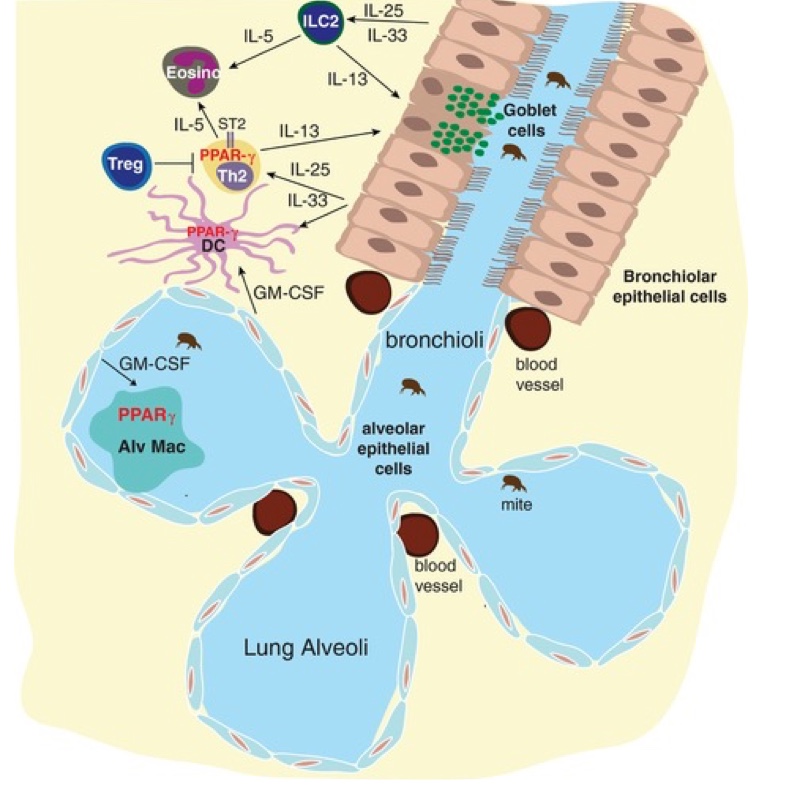
De nombreuses pistes suggèrent l’existence d’une voie Th9 dans la pathologie médiée par le SARS-CoV-2. En effet, au niveau des poumons, la protection immunitaire est essentiellement assurée par des macrophages appelés macrophages alvéolaires (MA). Ces MA expriment fortement le facteur de transcription PPARγ, Peroxysome Proliferator-Activated Receptor-γ, expression induite par le GM-CSF et le TGFβ au stade prénatal. (Yu, X. et al. 2017) (Schneider, C. et al. 2014) Le rôle crucial de ces MA PPARγ dans la réponse immunitaire antivirale des poumons fut d’ailleurs établie puisque, chez les animaux, une déficience en PPARγ aux premiers stades de développement hématopoïétique induit une absence de MA et aboutit à une immunodéficience fatale. En effet, les animaux développent une protéinose alvéolaire pulmonaire (PAP) sévère d’où la sensibilité aux infections virale, notamment la grippe et une déficience respiratoire. (Nobs & Kopf, 2018) (Schneider, C. et al. 2014 – b)
Aussi, les lipides semblent également jouer un rôle dans l’activation du PPARγ. Les principaux ligands du PPARγ sont probablement les lipides des tensioactifs oxydés, générés en continu par les échanges gazeux. (Nobs & Kopf, 2018) Or, le SARS-CoV-2 peut entrainer une oxydation des lipides du surfactant pulmonaire et donc, activer les MA PPARγ (Hasan, A. et al. 2021).
Par ailleurs, de manière très intéressante, le PPARγ est exprimé dans de nombreuses cellules immunitaires dont les cellules dendritiques, les lymphocytes B et T (Heming, M. et al. 2018). Et une étude récente a mis en évidence que les cellules Th9 constituent, en réalité, une sous-population de cellules Th2 PPARγ. (Micossé, C. et al. 2019). De plus, une autre catégorie de cellules sont associées à la Th9 : les ICL2, grands producteurs d’IL-5, d’IL-13 et d’IL-33. (Nobs & Kopf, 2018) (Moretti, S. et al. 2017) (Willard, M. A. M. et al. 2012). Or, l’IL-33 joue un rôle antiviral, en stimulant notamment l’activité des cellules immunitaires cytotoxiques (Kim, C. W. et al. 2019).
De plus, dans une publication récente, des auteurs ont démontré que l’IL-13 agit sur la charge virale du SARS-CoV-2 (Morrison C.B. et al. 2022). L’IL-13 est aussi impliquée dans l’asthme ainsi que les ICL2. De façon très intéressante, les personnes asthmatiques présentant un profil allergique semblent moins susceptibles de développer un covid sévère. Ces profils présentent une sécrétion d’IL-5, d’IL-13, une activation des éosinophiles et une production d’IgE, les anticorps responsables de la réponse allergique (Chung-Jen Wang et al. 2022).
Question : est-ce réellement bénéfique ?
Récemment, des IgE anti-S1 (Spike) et anti-NP (nucléocapsides) ont été mis en évidence dans des cas de covid sévère. (Tan, C. et al. 2022)
Le problème : les IgE sont impliquées dans les réactions d’hypersensibilité… Ils peuvent activer les mastocytes lors d’un contact ultérieur, ce qui entraîne la libération de chymase, une molécule qui active le système SRA et amplifie donc la pathologie COVID (Chung-Jen Wang et al. 2022) (Haimanot Wasse et al. 2012) (El-Arif, G. et al. 2021 – publication de l’équipe du Dr Jean-Marc Sabatier).
Une hypothèse peut également être émise : la réponse immunitaire lors d’un contact ultérieur avec les antigènes viraux, notamment la Spike virale ou « vaccinale » et les nucléocapsides, sera plus intense, le système immunitaire étant préparé à réagir violemment via les IgE et les mastocytes. D’ailleurs, les syndromes d’activation mastocytaire (MCA) peuvent être IgE dépendants (Valent, P. 2013). L’activation des mastocytes est encore mal diagnostiquée… cependant, elle a des effets sur le système cardio-vasculaire (Frieri, M. 2018) et le système nerveux (Mittal, A. et al. 2019), ce qui expliquerait bien des phénomènes liés aux covids dits « longs ». Pour finir, dans le cadre des injections à ARNm, on ignore encore le potentiel allergisant des nanoparticules (Hatziantoniou, S. et al. 2021). De ce fait, si le virus et les injections deviennent allergisants, alors les risques pour la santé et la sécurité des populations sont potentiellement inquiétants, notamment via l’activation des mastocytes : chocs anaphylactiques, syndromes de tachycardie posturale (PoTS), urticaires, problèmes immunitaires, etc.
Question : serait-ce un mécanisme rare ?
Clairement, non. L’IL-9, cytokine phare de la voie Th9, est impliquée dans l’inflammation pulmonaire via les ICL2. La papaïne est une molécule pouvant induire la production de cette cytokine dans un modèle d’étude de l’inflammation respiratoire (Wilhelm, C. et al. 2012). Or, on sait que les coronavirus, notamment le SARS-CoV2 produit des papain-like protéases (PLpro) nécessaires à leur reproduction, mais qui peuvent également agir sur le système immunitaire de l’hôte, comme bloquer la production d’IFN (Klemm, T. et al. 2020).
De plus, un article scientifique récent montre une augmentation de cellules Th9 dans le syndrome du Covid long (Acosta-Ampudia, Y. et al. 2022). Et on commence à peine à comprendre les implications possibles de la Th9 dans certaines pathologies, dont les infections virales comme le VIH. (Chen, J. et al. 2019)
Conclusion : un tableau immunitaire incomplet
Les mécanismes d’induction de la réponse immunitaire par le SARS-CoV-2 sont « relativement » bien connus. Le déclenchement de la voie des interférons de type I, les inflammasomes, l’activation des NK qui lysent les cellules infectées, l’induction d’une réponse immunitaire spécifique de type cellulaire (Th1) sont bien étayés et sont congruents avec l’état actuel des connaissances en immunologie. Il s’agit bien d’une réponse immunitaire antivirale typique.
Toutefois, il reste un grand nombre d’inconnues. Il manque des données concernant les éosinophiles, les basophiles et les mastocytes, l’implication du système du complément et celle des peptides antimicrobiens. Les voies Th17, Th22 et Th9 doivent être impérativement explorées, car elles peuvent potentiellement induire des mécanismes immunitaires dangereux comme les réactions allergiques. Si le système immunitaire est sensibilisé, notamment contre la protéine Spike, alors la réponse immunitaire sera disproportionnée, voire léthale lors d’un contact ultérieur avec, soit le virus, soit les « vaccins ».
Il faut préciser que les réponses immunitaires ne se déroulent pas selon un ordre préétabli. Une réponse Th17/Th22 peut se déclencher en parallèle à une Th1, comme dans le syndrome de Guillain-Barré (Li, S. et al. 2014). Il faut garder en tête que toutes les réponses immunitaires sont intriquées les unes aux autres et peuvent coopérer entre elles, s’induire ou s’inhiber selon le contexte physiopathologique. Pour illustrer ce phénomène, les voies Th9 et Th17 concourent à l’aggravation du cancer du poumon et à la formation des métastases (Salazar, Y. et al. 2020), les voies Th1/Th2/Th9 et Th17 participent à la cirrhose hépatique (He, Y. et al. 2021), etc.
Il est à noter que les cellules immunitaires, non seulement collaborent entre elles, mais sont également « plastiques ». En effet, selon le contexte et les cytokines produites, les LT CD4+ peuvent passer d’un phénotype Th1 ou Th2 à un phénotype Th17 par exemple (Karpisheh,V. et al. 2022).
Par ailleurs, chaque jour apporte son lot de découvertes. En effet, récemment, deux nouveaux récepteurs cellulaires viennent d’être identifiés : ASGR1 et KREMEN1. D’après les études (Gu, Y. et al. 2022)(Koffmann, M. et Pöhlmann, S. 2021), le domaine RBD de l’unité S1 de la Spike virale peut se lier aux récepteurs ACE2, ASGR1 et KREMEN1, et permettre au virus d’entrer dans les cellules. Mais, de façon intéressante, le domaine NTD de S1 peut aussi interagir avec ASGR1 et KREMEN1. Quant à l’unité S2 de la protéine Spike, elle semble également présenter une certaine affinité avec KREMEN1. Or, la plupart des publications mesurant l’efficacité des injections anti-covid sont basées sur la production ou l’étude des anticorps anti-RBD de la protéine Spike (Barin, B. et al. 2022). Si le virus peut pénétrer dans les cellules via d’autres récepteurs au moyen d’autres domaines, il convient alors de se demander si les anticorps produits par les injections anti-covid contre le domaine RBD de Spike sont efficaces pour neutraliser le virus. Toujours d’après ces auteurs, la réponse est négative et cela peut fournir une explication quand à l’inefficacité de la protection conférée par la campagne vaccinale (Gu, Y. et al. 2022)(Koffmann, M. et Pöhlmann, S. 2021). Au-delà de la problématique vaccinale, il est nécessaire d’étudier la distribution, l’expression et l’activation de ces récepteurs pour comprendre les mécanismes inflammatoires pouvant être induits via ces récepteurs, à l’instar du récepteur ACE2.
Pour finir, il semble que le SARS-CoV-2 possède des mécanismes similaires à ceux du VIH. Outre les mécanismes déjà décrits (CD147, les G-MDSCs, les syncytiums et le système Fas/FasL), une étude récente montre que le virus peut infecter directement les lymphocytes T, notamment les LT CD4+, via un récepteur : le LFA-1 (Shen, X.-R. et al. 2022). Or, le LFA-1 est une clé d’entrée du VIH dans les lymphocytes T CD4+ (Tardif, M.R. & Tremblay, M.J. 2005). Le SARS-CoV-2 induirait donc une immunodéficience, comme le VIH, en induisant notamment l’apoptose de ces cellules cibles.
Vous l’avez compris, les découvertes en immunologie concernant le SARS-CoV-2 sont loin d’être achevées… Et pour complexifier l’affaire, les campagnes « vaccinales » anti-covid affectent aussi le système immunitaire et les mécanismes seront décrits dans un prochain article.
Toutes les références bibliographiques sont disponibles ici.
À LIRE AUSSI

L'article vous a plu ? Il a mobilisé notre rédaction qui ne vit que de vos dons.
L'information a un coût, d'autant plus que la concurrence des rédactions subventionnées impose un surcroît de rigueur et de professionnalisme.
Avec votre soutien, France-Soir continuera à proposer ses articles gratuitement car nous pensons que tout le monde doit avoir accès à une information libre et indépendante pour se forger sa propre opinion.
Vous êtes la condition sine qua non à notre existence, soutenez-nous pour que France-Soir demeure le média français qui fait s’exprimer les plus légitimes.
Si vous le pouvez, soutenez-nous mensuellement, à partir de seulement 1€. Votre impact en faveur d’une presse libre n’en sera que plus fort. Merci.



