Conséquences immunologiques des injections anti-Covid-19 : éléments de réponse sur les nanoparticules lipidiques

Bien que de nombreux traitements précoces existent pour soigner les gens atteints par le coronavirus, dès janvier 2021, les autorités sanitaires et gouvernementales ont choisi d’utiliser des médicaments expérimentaux – notamment Comirnaty (Pfizer BioNTech) et Spikevax (Moderna) - d’abord chez les personnes fragiles susceptibles de développer des formes graves de la covid-19 puis de les étendre à toute la population française. Aujourd’hui, les annonces du gouvernement ciblent spécifiquement les enfants et les femmes enceintes, et les mesures prises visent également à injecter une quatrième dose aux professionnels de Santé.
Alors, quel est l’état des connaissances en immunologie concernant lesdits produits ? Comment le corps réagit aux injections ? Est-ce efficace ? Est-ce dangereux ?
Des composants problématiques
Que ce soit Comirnarty ou Spikevax, les nanoparticules lipidiques (NPLs) sont composées essentiellement de :
- phospholipides et cholestérol pour assurer la structure,
- d’ARNm modifié encodant la protéine Spike,
- de phospholipides cationiques,
- de lipides PEGylés (« PEG-lipids »)
(Schoenmaker, L. et al. 2021)(Sato Yusuke, 2021)(Vu, M. N. et al. 2021)
Si les phospholipides et le cholestérol, composants majeurs des membranes plasmiques cellulaires, sont relativement inoffensifs pour l’organisme pour peu que leurs origines soient contrôlées, les trois autres types de composants sont potentiellement problématiques d’un point vue immunologique.
I. Le PEG ou le polyéthylène glycol
Les lipides modifiés avec le polyéthylène glycol (PEG), comme le PEG2000-DMG (1-monomethoxypolyyethylene glycol 2000 -2, 3-dimyristylglycérol) pour Spikevax de Moderna ou l’ALC-0159 (2-((polyethylene glycol)-2000-N, N- ditetradecylacetamide) pour Comirnaty de Pfizer, permettent de contrôler la taille des nanoparticules et agissent comme une barrière stérique pour éviter leur agrégation pendant le stockage (Shoenmaker, L et al. 2021)(Szebeni J. et al. 2022). Ils forment comme un manteau recouvrant la surface des nanoparticules. Ils stabilisent les nanoparticules, augmentant ainsi leur demi-vie (Pardi, N. et al. 2018). Cependant, ces PEG posent un « petit » problème sur le plan immunologique.
Le polyéthylène glycol (ou PEG) est utilisé dans la formulation de nombreux produits cosmétiques et pharmaceutiques, notamment pour réduire l’immunogénicité de certaines molécules (Kozma, G. T. et al. 2020). L’immunogénicité est définie comme étant la capacité d’une molécule, protéine ou lipide ou glucide, à induire une réponse immunitaire à son encontre (Janis Kuby, 7ᵉ édition, Dunod). De fait, les PEG en solution ne présentent qu’une très faible, voire aucune, immunogénicité même en présence d’adjuvant. En somme, ils n’activent pas le système immunitaire. Néanmoins, quand ils sont conjugués à des macromolécules ou à des nanoparticules, ils deviennent immunogènes, comme peuvent l’être des haptènes lorsqu’ils sont combinés à des protéines carrier (Kozma, G. T. et al. 2020).
D’ailleurs, des chercheurs ont mis en évidence la présence d’anticorps anti-PEG préexistants (des IgM, des IgG et des IgE) chez des individus sains ou sous traitement médical, pouvant déclencher une réponse de type allergique lors d’un second contact avec ces molécules (Chen, B.M. et al. 2016)(Hong, L. et al. 2020)(Zhou, Z.-H. et al. 2021). Les IgE anti-PEG peuvent, bien entendu, provoquer l’activation de mastocytes ou de basophiles présensibilisés, déclenchant ainsi une réponse allergique de type I – c’est-à-dire anaphylactique (Szebeni, J. et al. 2022). Les anticorps anti-PEG de type IgM ou IgG peuvent activer le système du complément, induisant un autre phénomène : le CARPA ou « complement activation-related pseudoallergy » (Szebeni, J. 2014). Cette réaction est aussi dangereuse pour l’organisme que celle médiée par les IgE anti-PEG. En effet, l’activation du complément génère des anaphylatoxines (C3a, C4a et C5a) qui agissent comme des cytokines et activent les cellules immunitaires, dont les mastocytes, provoquant une réaction pseudo-allergique (Hydar Ali, 2010).
Autre point d’intérêt : la production de novo d’anticorps anti-PEG, phénomène pouvant être entretenu par l’activation du système du complément (Kozma, G. T. et al. 2020).
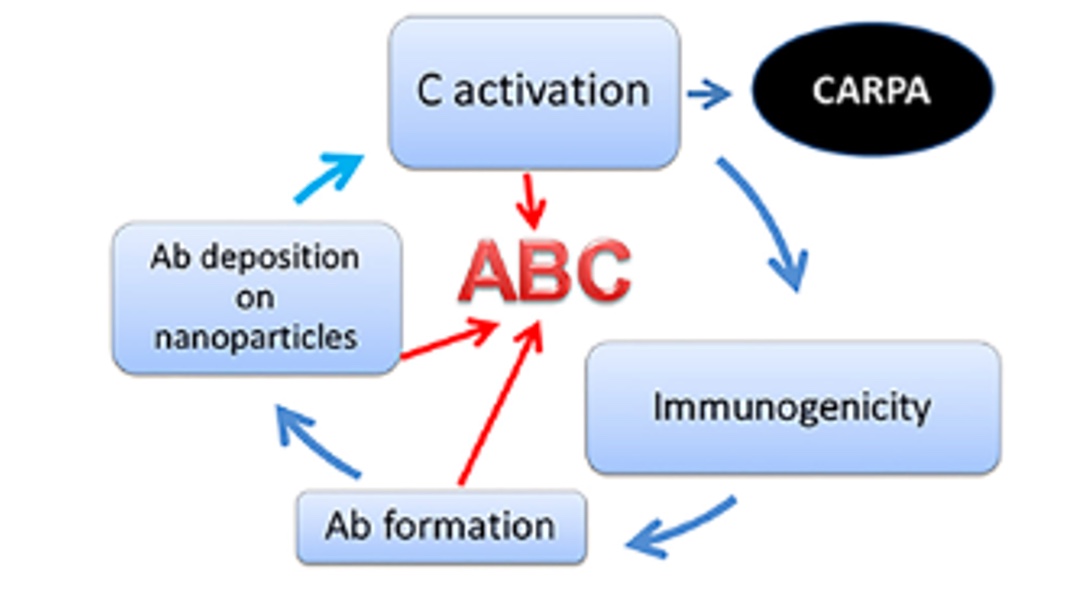
“Anti-PEG antibodies: Properties, formation, testing and role in adverse immune reactions to PEGylated nano-biopharmaceuticals”
D’après cette étude, les lipides PEGylés présentent une immunogénicité croissante selon le poids moléculaire, la complexité et les propriétés physico-chimiques des groupements terminaux. Or, les PEG utilisés dans la formation de Spikevax ou de Comirnaty possèdent respectivement des groupements « méthoxy- » et « -acétamide », groupements favorisant l’apparition d’anticorps anti-PEG, donc immunogènes. Les auteurs précisent aussi que si les lipides PEGylés recouvrent des nanoparticules, la réponse immunitaire induite semble être plutôt humorale que cellulaire. Dans ce cas de figure, les lymphocytes B s’activent au contact des PEG, se transforment en plasmocytes et produisent d’abord des IgM anti-PEG. Ensuite, la commutation de classe intervient et les cellules activées synthétisent des IgG anti-PEG par exemple.
Il s’ensuit une boucle d’amplification.
D’après le schéma ci-dessus, les anticorps anti-PEG nouvellement produits permettent d’activer le système du complément, et donc la production d’anaphylatoxines, ce qui induit une réaction d’hypersensibilité de type CARPA. L’autre conséquence est l’opsonisation des particules PEGylées par le complément, ce qui déclenche un phénomène ABC pour « Accelerated Blood Clearance ». En effet, l’activation du complément et l’opsonisation font le lien entre immunité innée et adaptative, ce qui permet d’accroître la production d’anticorps anti-PEG pour éliminer les nanoparticules présentes dans l’organisme. Cela affecte non seulement l’efficacité des produits dits « vaccinaux » puisqu’ils seront neutralisés par les anticorps avant même d’intégrer les cellules, mais prépare aussi l’organisme à répondre aux nanoparticules de manière dangereuse via une réponse de type allergique.
Pourquoi est-ce important ? Les anticorps anti-PEG de type IgM ou IgG, bien connus pour activer le système du complément, et donc induire une pseudo-allergie CARPA, peuvent aussi induire des hypersensibilités de type II ou de type III (Szebeni, J. et al. 2022). Les réactions d’hypersensibilité de type II font intervenir les Natural Killer (ou NK) dans un mécanisme ADCC (« Antibodies dependant cells cytotoxicity ») que nous retrouverons ultérieurement (Shammas F. Bajwa & Reem Hamdy A. Mohammed. 2021). Les réactions d’hypersensibilité de type III mettent en jeu des complexes immuns pouvant provoquer une réponse inflammatoire médiée par les macrophages ou les neutrophiles, et affecter les vaisseaux sanguins, les reins et les articulations (Norina Usman & Pavan Annamaraju, 2021). Il est aussi important de savoir que les réactions d’hypersensibilité de type II ou III prennent plusieurs minutes à plusieurs heures pour se développer. Ils peuvent donc passer inaperçus après l’injection des nanoparticules et se déclencher à retardement.
Est-ce un phénomène rare ? Peut-être. Il est à noter que les IgE anti-PEG peuvent interagir avec le polysorbate 80 ou E433, un additif de synthèse utilisé dans l’industrie agroalimentaire comme émulsifiant dans les produits laitiers, le lait de coco, les soupes, les sauces (Szebeni, J. et al. 2022)… Les allergies alimentaires doivent être prises au sérieux dans cette campagne vaccinale, tout comme un dosage des anticorps anti-PEG permettrait un dépistage des individus susceptibles de développer une hypersensibilité lors des injections (Ehlinger, C. et al. 2019).
Petit recensement :
- En France, 6 cas de réaction d’hypersensibilité ont été répertoriés (https://archyde.com/six-cases-of-adverse-effects-caused-by-the-pfizer-vaccine-recorded-in-france/),
- Aux Etats-Unis, 175 réactions allergiques sévères (https://www.cdc.gov/mmwr/volumes/70/wr/mm7002e1.htm),
- 21 cas en Suisse dont 5 létaux (https://www.swissmedic.ch/swissmedic/en/home/news/coronavirus-covid-19/verdachtsmeldungen-impfstoff-covid19.html).
Phénomène rare peut-être, mais potentiellement mortel (Szebeni, J. et al. 2022).
Pour finir cette partie, d’après certaines études, le PEG inhibe sérieusement la libération de l’ARNm dans le cytoplasme, un phénomène appelé le dilemme du PEG (« PEG dilemma ») (Hatakeyama, H. et al. 2011)(Hatakeyama, H. et al. 2013). Pour limiter ce mécanisme, la formulation des nanoparticules fut modifiée et des lipides cationiques furent ajoutés. Et ces lipides cationiques sont loin d’être inoffensifs.
II. Les lipides ionisables cationiques
Les lipides cationiques sont essentiels pour encapsuler les acides nucléiques comme l’ARNm et permettre une libération de ces derniers dans le cytoplasme cellulaire (Sato Yusuke, 2021)(Buschmann, M.D. et al. 2021)(Samaridou, E. et al. 2020).
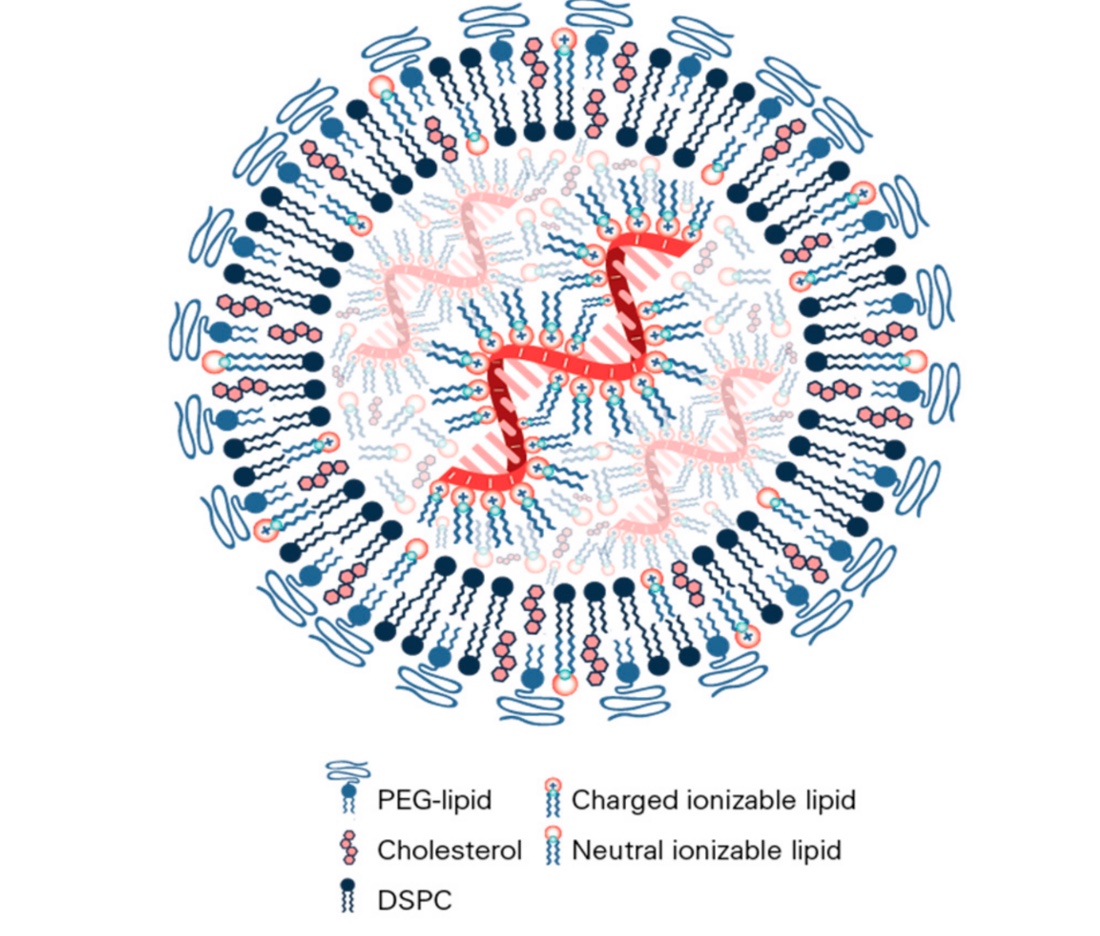
https://doi.org/10.3390/vaccines9010065.
“Nanomaterial Delivery Systems for mRNA Vaccines”
Seulement, les lipides cationiques possèdent une charge positive. Cette charge positive perturbe la biodistribution des nanoparticules dans l’organisme et active le système du complément. De plus, ils sont relativement toxiques, notamment pour les hépatocytes (Sato Yusuke, 2021).
Par conséquent, une autre catégorie de lipides fut développée. Il s’agit de lipides ionisables qui deviennent cationiques quand le pH diminue, ce qui est le cas dans les endosomes. En effet, les cellules peuvent internaliser les nanoparticules lipidiques par un mécanisme d’endocytose, ce qui aboutit à la formation d’endosomes. Ces vésicules s’acidifient, ce qui permet aux lipides ionisables de se charger positivement puis de déstructurer l’endosome pour libérer l’ARNm dans le cytoplasme cellulaire (Sato Yusuke, 2021)(Hou, X. et al. 2021)(Reichmuth, A. M. et al. 2016). Ces lipides ionisables sont l’ALC-0315 pour le BNT162b2 (Pfizer) et le SM-102 pour le mRNA-1273 (Moderna) (Schoenmaker, L. et al. 2021)(Buschmann, M. D. et al. 2021).
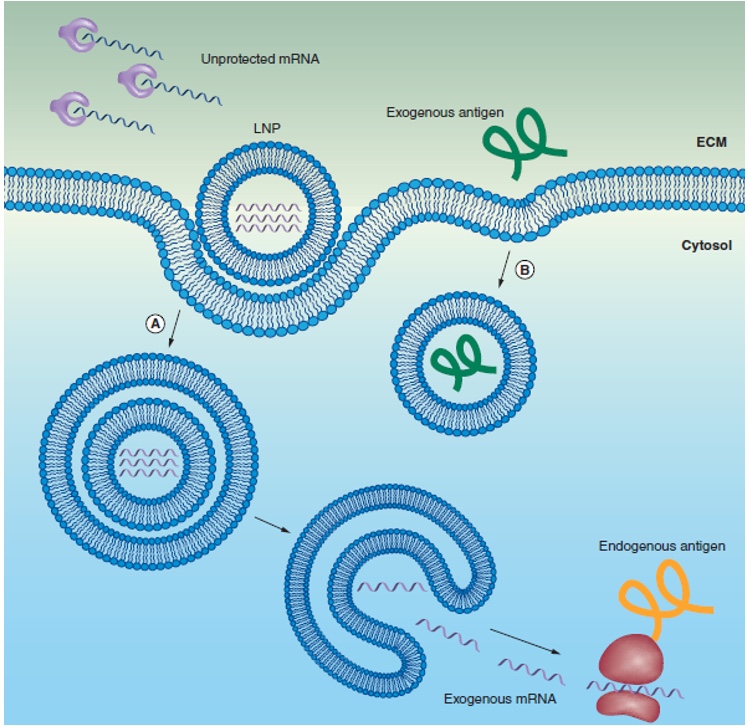
10.4155/tde-2016-0006, Ther. Deliv. (2016) 7(5), 319–334
“mRNA vaccine delivery using lipid nanoparticles”
Comment les lipides cationiques ionisables interagissent avec le système immunitaire ? Les données sont plus que parcellaires (Li, C. et al. 2022).
Concernant les lipides cationiques, une étude menée par Arindam K. Dey (Dey, A. K. et al. 2021) montre qu’ils augmentent de manière significative l’activité des macrophages alors que l’impact sur les cellules dendritiques semble plus minime. Les auteurs ont néanmoins mesuré une production accrue d’IL-6, de TNFα et de MCP-1 par ces cellules quand elles sont co-stimulées par les lipides cationiques et le LPS, un antigène bactérien. Il s’agit de cytokines pro-inflammatoires impliquées notamment dans le recrutement et l’activation de monocytes et de macrophages sur le site d’intérêt. Les auteurs mettent aussi en évidence des perturbations dans le métabolisme de ces cellules, surtout au niveau des mitochondries, par les lipides cationiques de façon dose-dépendante. D’ailleurs, il semble que les lipides cationiques complexés à des acides nucléiques présentent une activité inflammatoire moindre : les acides nucléiques étant chargés négativement, ils contrebalancent les charges positives de ces particules. Arindam K. Dey et son équipe concluent que les macrophages et les cellules dendritiques répondent différemment aux lipides cationiques. Il leur semble donc pertinent d’étudier ces deux types cellulaires dans le cadre d’analyses d’immunotoxicité. En effet, si à faible concentration, les lipides cationiques n’altèrent pas le fonctionnement de ces cellules, à forte concentration, ils induisent bel et bien des perturbations métaboliques et ces effets sont proportionnels à la charge nette positive présente au niveau des nanoparticules.
De façon très intéressante, une étude semble montrer que les nanoparticules lipidiques à ARNm formulés avec ces lipides cationiques ionisables conservent leurs propriétés d’adjuvant (Pardi, N. et al. 2018). Par définition, un adjuvant est une substance capable de stimuler le système immunitaire afin de déclencher une réponse d’abord inflammatoire puis spécifique (Reichmuth, A. M. et al. 2016). Il s’agit de la réactogénicité des produits vaccinaux (Hervé, C. et al. 2019). D’ailleurs, les essais cliniques des produits développés par Pfizer ou Moderna ont mis en évidence des effets secondaires comme la douleur, la fièvre, des œdèmes et de la fatigue (Jackson, L. A. et al. 2020)(Sahin, U. et al. 2020)(Walsh, E. E. et al. 2020), des signes évoquant l’activation de la réponse immunitaire de type inflammatoire.
Afin de mettre ce phénomène en évidence, Sonia Ndeupen et son équipe ont élaboré des protocoles expérimentaux permettant de mesurer la production de cytokines et de chimiokines au niveau des sites d’injection, en intramusculaire et en intradermique, et d’évaluer l’activation des cellules immunitaires lors d’inoculations de nanoparticules, notamment en intranasal, chez la souris (Ndeupen, S. et al. 2021). Les résultats sont éloquents. Les nanoparticules délivrées en intranasal provoquent une infiltration massive de neutrophiles et d’éosinophiles dans les heures qui suivent leur administration. Elles sont si toxiques, inflammatoires au niveau des poumons, qu’elles tuent environ 80% des souris en 24 heures.
Les injections en intramusculaire induisent aussi une forte infiltration de neutrophiles et de macrophages sur le site d’intérêt, bien plus que de cellules dendritiques, dans les premières heures et premiers jours suivant la piqûre.
En intradermique, il y a une forte production de cytokines et de chimiokines pro-inflammatoires : CCL2 (Monocyte chemotactic protein-1 ou MCP-1), CCL3 (Macrophage inflammatory protein-1-α ou MIP-1-α), CCL4 (Macrophage inflammatory protein-1-β ou MIP-1-β), CCL7 (Monocyte-chemotactic protein 3 ou MCP-3), CCL12 (Monocyte-chemotactic protein-5 ou MCP-5), et enfin les chimiokines CXCL1 et CXCL2. De façon concomitante, sont produites des cytokines comme l’IL-1β, l’IL-6 et le GM-CSF (Granulocyte Macrophage-colony stimulating factor) et les gènes correspondants aux cytokines précédemment énumérées sont fortement exprimés. Ces molécules pro-inflammatoires sont associées au développement des monocytes et des granulocytes, auxquels appartiennent les neutrophiles, ainsi qu’au recrutement et à l’activation de ces cellules (Sokol, C.L. & Luster A.D. 2015). De plus, une levée d’inhibition des gènes correspondants aux inflammasomes - notamment le Nlrp3, et une inhibition du gène Nlrp10 connu pour contrer ces derniers, ont été observés (Ndeupen, S. et al. 2021).
Les résultats expérimentaux obtenus par l’équipe de Sonia Ndeupen sont partiellement corroborés avec ceux de l’équipe de Chunfeng Li (Li, C. et al. 2022). Ces chercheurs ont bien mis en évidence une production de CCL2, CCL4 et d’IL-6 chez la souris à la suite d’injections de BNT162b2 (Comirnaty, Pfizer) en intramusculaire, avec celle de CCL5 après une seconde administration du produit. Les profils cytokiniques ayant été établis en intradermique pour S. Ndeupen mais en intramusculaire pour C. Li, les résultats peuvent diverger quelque peu.
En outre, de manière très intéressante, l’équipe de C. Li démontre une forte production d’IFN-γ et de CXCL10 dans le modèle murin (Li, C. et al. 2022). Or, ces deux cytokines ont également été mises en évidence chez l’homme (Arunachalam, P.S. et al. 2021) ainsi que de l’IL-15, de l’IL-8, du CCL3 et CCL4 après la première injection, cytokines accompagnées de l’IL-7 et de l’IL-12 après la seconde injection (Bergamaschi, C. et al. 2021). Pour information, la cytokine CXCL10, encore appelée IP10, est une petite chimiokine pro-inflammatoire capable de recruter des lymphocytes T, des NK, des monocytes, des éosinophiles, des neutrophiles et des mastocytes en se liant au récepteur CXCR3 (Sokol, C.L. & Luster A.D. 2015)(Metzemaekers M. et al. 2020)(Vazirinejad, R. et al. 2014)(Jinquan, T. et al. 2000). Aussi, la production d’autres cytokines d’intérêt a été observée comme l’IL-6, le TNFα et l’IL-21 chez l’homme (Arunachalam, P.S. et al. 2021)(Miyashita, Y. et al. 2022) ainsi qu’une sécrétion d’IL-1β, cytokine généralement en lien avec la mise en place d’inflammasomes comme le Nlrp3, mais pour des nanoparticules lipidiques semblables à ceux de Moderna (Tahtinen, S. et al. 2022).
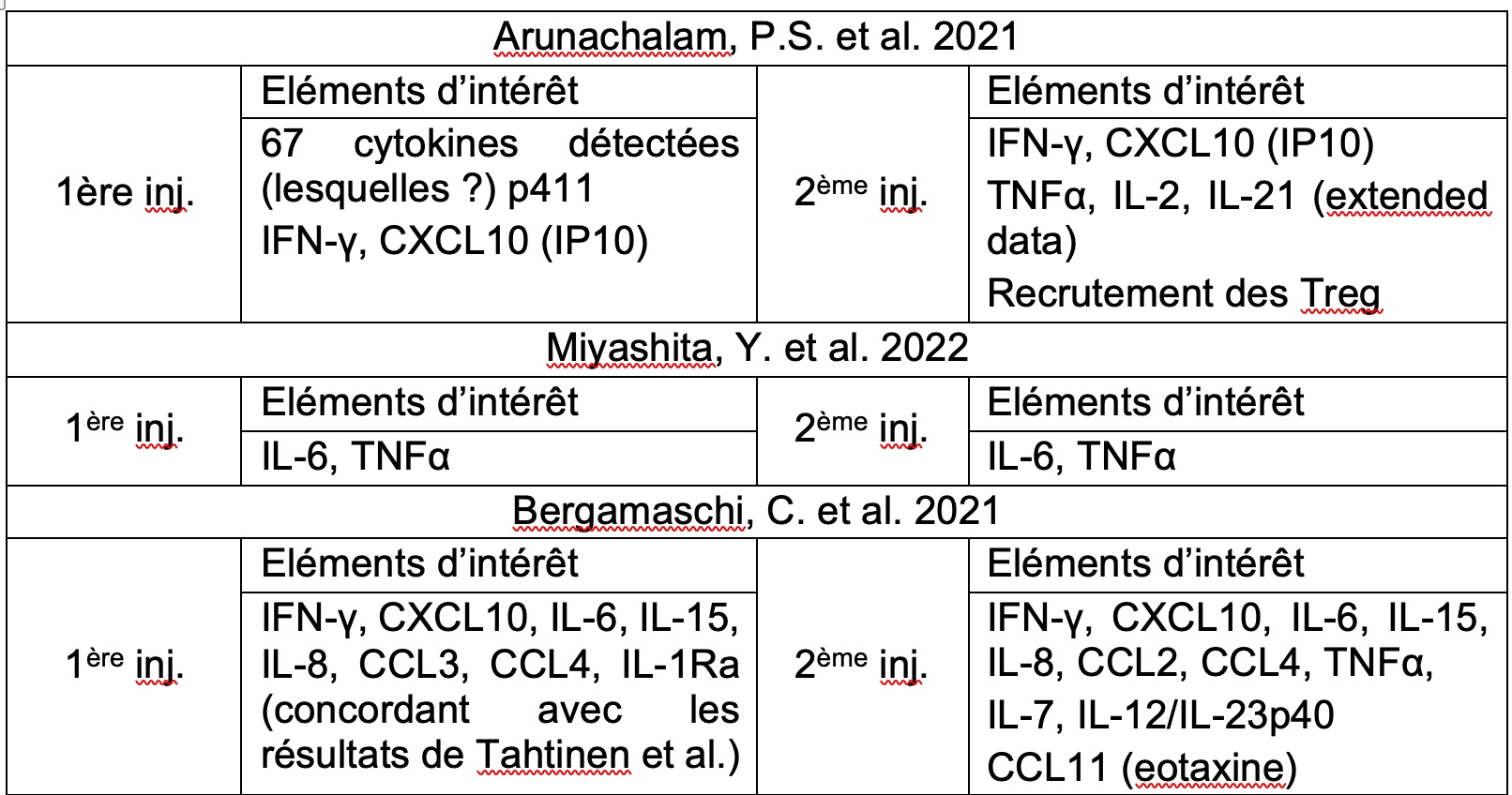
Quoi qu'il en soit, l’ensemble des cytokines identifiées dans ces études est cohérent par rapport aux types de cellules immunitaires activées, à savoir les monocytes, les macrophages et les cellules dendritiques ainsi que les NK, suivies de près par les lymphocytes T (Sokol, C.L. & Luster A.D. 2015)(Arunachalam, P.S. et al. 2021)(Li, C. et al. 2022)(Sadarangani, M. et al. 2021). Tout indique une réponse immunitaire à médiation cellulaire et les données sont congruentes.
Il est important de préciser que les équipes de Prabhu S. Arunachalam et de Chunfeng Li ont identifiés des sous-populations monocytaires qui semblent conditionnées de façon épigénétique pour répondre de manière plus intense au fur et à mesure que l’organisme est exposé aux nanoparticules lipidiques (Arunachalam, P.S. et al. 2021)(Li, C. et al. 2022). En effet, des analyses du transcriptome montrent une expression accrue des gènes liés à l’IFN-γ dans ces cellules à la suite d’une seconde injection. Ce conditionnement des cellules immunitaires innées peut expliquer en partie l’amplification de la réponse immunitaire observée à la suite des secondes et troisièmes administrations de « vaccins » anti-covid (Röltgen, K. et al. 2022).
Chaque élément précité est important et peut jouer un rôle délétère dans la réponse immunitaire induite par les nanoparticules lipidiques à ARNm modifié encodant la protéine Spike du SARS-CoV-2. Plutôt que de les décrire un par un, il semble préférable de les contextualiser afin de dresser un tableau de la réponse immunitaire induite par les injections.
Mais avant cela, il manque un dernier élément à étudier et non des moindres : l’ARN messager modifié.
III. L’ARNm modifié
Que ce soit le Comirnaty ou Moderna, les nanoparticules contiennent de l’ARNm modifié encodant la protéine Spike du SARS-CoV-2 (Schoenmaker, L. et al. 2021). Pourquoi avoir utilisé de l’ARNm modifié encapsulé dans des nanoparticules lipidiques ?
Physiologiquement, les ARNm sont des acides nucléiques qui servent de support à la production des protéines dans les cellules. Ils sont issus de la transcription d’un gène au niveau de l’ADN, un mécanisme qui se déroule dans le noyau cellulaire, et la traduction, c’est-à-dire la production de la protéine encodée, s’accomplit dans le cytoplasme via les ribosomes.
ADN et ARN sont différents. En effet, l’ADN est composé de désoxyribonucléotides constitués à partir des bases azotées suivantes : adénine, thymine, cytosine et guanine (A, T, C, G). Ces bases s’apparient deux à deux via des liaisons H : A-T (2 liaisons H), C-G (3 liaisons H). De ce fait, l’ADN est une longue molécule formée de deux brins enroulés en une double hélice. Cette structure est dite bicaténaire. De plus, l’un des deux brins est dit « codant » car il contient la séquence qui encode une protéine. L’autre brin est donc « non-codant » (le complément).
Les ARN sont monocaténaires (un seul brin) et ils sont constitués de ribonucléotides avec les bases azotées adénine, uracile, cytosine et guanine (A, U, C, G). Dans le cytoplasme, les ribosomes vont « lire » le code servant à la production des protéines porté par l’ARNm. Pour expliquer simplement, un acide aminé – brique élémentaire constituant les protéines – est « encodé » par un codon d’acides nucléiques. Ce codon est formé par 3 bases, ce qui fait 64 associations possibles. Par conséquent, si un codon équivaut à un acide aminé, un acide aminé peut être encodé par plusieurs codons. Il y a des codons « marche » et des codons « arrêt » qui permettent aux ribosomes de savoir quand et où il faut lancer la traduction et quand l’arrêter. Les protéines étant constituées d’une séquence en acides aminés, l’ordre d’agencement des codons est très important.
De plus, la production protéique est liée à la différenciation cellulaire. En effet, une cellule ne produit pas une protéine si cette dernière ne correspond pas à ses attributions biologiques. Par exemple, un neurone ne synthétise pas de l’insuline. Cette production est propre aux cellules β de Langherans, cellules localisées au niveau du pancréas. Pourtant, le génome des cellules nerveuses et des cellules β de Langherans d’un individu donné est strictement identique, mais leur protéome, c’est-à-dire l’ensemble des protéines produites par ces cellules, est différent. Quand la cellule se différencie, les gènes encodant les protéines inutiles à sa fonction cellulaire deviennent silencieux, parfois de façon définitive, parfois de façon temporaire. L’activation de récepteurs membranaires, grâce aux ligands (en immunologie, cela peut être des cytokines par exemple), induit celle de gènes inhibés via un phénomène bien particulier, la transduction du signal. Il s’agit d’une levée d’inhibition : la transcription des gènes inhibés est lancée et il s’ensuit la traduction dans le cytoplasme de la cellule. C’est ainsi que la cellule, notamment les cellules immunitaires, adapte son activité en fonction des signaux qu’elle reçoit.
Nota bene : Il existe aussi des gènes dont la transcription se fait continuellement. Les protéines ribosomales, celles du CMH I ou encore les enzymes du métabolisme en sont des exemples. Ces protéines remplissent généralement des fonctions biologiques communes à toutes les cellules de l’organisme. Par ailleurs, un ARNm a une durée de vie limitée dans le temps et est facilement dégradé par des ribonucléases.
Pour finir cette partie introductive, dans le noyau, juste après la transcription, l’ARNm fait l’objet de plusieurs modifications ayant pour objectifs de le stabiliser, de prévenir toute dégradation prématurée de la molécule par les enzymes cytoplasmiques, et, enfin, de peaufiner la séquence encodant la séquence protéique. Dans un premier temps, une coiffe est fixée à l’extrémité 5’ du transcrit primaire. Elle est constituée par une guanine méthylée. Cette coiffe facilite la liaison entre l’ARNm et le ribosome lors du lancement de la traduction. Aussi, elle semble protéger l’ARNm d’une catalyse intempestive médiée par les enzymes cytoplasmiques. Ensuite, une queue polyadénylée (ou « queue polyA »), constituée par une succession d’acides adényliques en nombre variable (compris entre 20 et 200), est fixée à l’extrémité 3’ par une enzyme spécifique, la polyA polymérase. Cette queue polyA est caractéristique des ARNm et prévient les dégradations cytoplasmiques. Enfin, il faut préciser que, dans de nombreux cas, un gène peut encoder plusieurs protéines différentes. En effet, seules certaines portions du gène sont nécessaires pour la production d’une protéine. Ces gènes sont dits morcelés ou gènes « mosaïques ». Par conséquent, le pré-ARN messager contient un certain nombre de séquences à éliminer. Ces séquences sont appelées introns (introns pour « intrus »). Les portions du pré-ARN messager encodant la protéine sont appelées exons. L’élimination des introns s’effectue par un mécanisme d’excision et d’épissage. L’excision permet de couper les introns et l’épissage permet d’assembler les exons entre eux pour former l’ARNm définitif. Ce sont des processus extrêmement précis, qui se déroulent au nucléotide près. Ils s’effectuent via des complexes macromoléculaires contenant plusieurs protéines et petites molécules d’ARN : les spliceosomes. De plus, les ARNm peuvent également retirer des exons. Il s’agit de l’épissage alternatif. C’est ainsi qu’à partir d’un même gène, il est possible de produire plusieurs protéines différentes.
Source : « Génétique » de Susan ELROD et William STANSFIELD – 2003 ISBN : 2-10-006653 6
Dans le cadre des injections anti-covid, comme les ribonucléases sont très abondantes notamment dans le milieu extracellulaire, sans la capsule lipidique, les ARNm « naïfs » (sans modifications) seraient dégradés rapidement, avant même d’être intégrés dans les cellules de l’organisme (Pardi, N. et al. 2018). Ensuite, les cellules sont capables de détecter la présence d’ARNm exogènes via des récepteurs spécialisés comme les TLR (« Toll-like receptors), déclenchant une réponse cellulaire capable de les bloquer et de les dégrader tout aussi rapidement, ce qui est contre-productif dans le cadre d’une vaccination (Pardi, N. et al. 2018)(Schoenmaker, L. et al. 2021). En effet, les vaccins ont pour objectif d’immuniser un organisme contre un pathogène donné afin de s’en prémunir et, pour ce faire, il est nécessaire d’induire une réponse immunitaire suffisamment forte envers un antigène spécifique du micro-organisme (Bhurani V. et al. 2018).
Par conséquent, de nombreux travaux ont été menés pour accroître la stabilité et la production protéique des ARNm tout en diminuant leur immunogénicité (Pardi, N. et al. 2018)(Schoenmaker, L. et al. 2021).
Pour faire simple, les modifications apportées sont (cf. schéma ci-dessous) :
- Une coiffe en 5’, des régions non traduites (UTRs pour « Untranslated Transcribed Regions ») et une queue polyadénylée,
- Des codons optimisés avec un enrichissement en CG (Cytosine/Guanine),
- L’utilisation d’uridine méthylée (1-methyl-pseudouridine) à la place d’UTP (ribonucléotide triphosphate avec de l’uracile) lors de la production.
Bien entendu, ces modifications vont accroître la production des antigènes – dans ce contexte, il s’agit de la protéine Spike - (Buschmann, M. D. et al. 2021) et cela va affecter les cellules de l’organisme, y compris les cellules immunitaires. La réponse immunitaire à l’encontre de Spike sera d’ailleurs détaillée dans l’article suivant. De plus, certaines de ces modifications vont se répercuter au niveau immunitaire directement, avant même la production de la Spike.
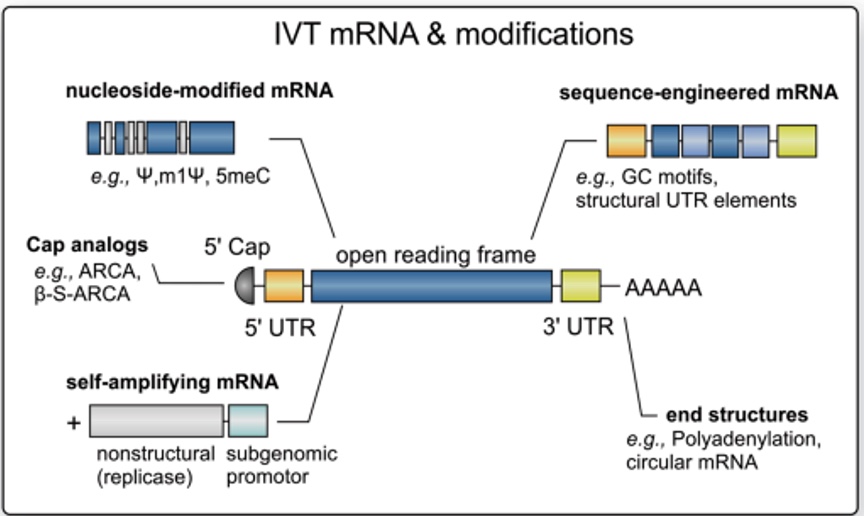
https://doi.org/10.1016/j.ijpharm.2021.120586
“mRNA-lipid nanoparticle COVID-19 vaccines: Structure and stability”
Outre l’emploi potentiellement problématique de la pseudouridine dans les processus industriels (Chen, T.-H. et al. 2022) ou leurs éventuels impacts sur le transcriptome cellulaire (Martinez, N. M. et al. 2022)(Seneff, S. et al. 2022), cette modification réduit considérablement l’immunogénicité de l’ARNm (Pardi, N. et al. 2018)(Schoenmaker, L. et al. 2021). Normalement, les acides nucléiques, dont l’ARN du SARS-CoV-2, sont détectés par les TLRs, les RLRs et les NLRs, ce qui permet de déclencher la voie de l’interféron, la mise en place d’inflammasomes et une réponse immunitaire antivirale appropriée (Diamond, M. S. and Kanneganti, T.-D. 2022). Dans le cadre d’une vaccination, cela permet d’initier la réponse immunitaire et donc, à plus long terme, d’induire une protection immunitaire pérenne de l’organisme (Hervé, C. et al. 2019). Or, bien que la production de DAMPs ait été détectée à la suite des injections de BNT162b2 (Pfizer) en intramusculaire, les TLRs et les NLRs ne semblent pas impliquer dans la mise en place des inflammasomes ni dans la production d’IFNα (Li, C. et al. 2022). Seul le MDA5, un senseur appartenant à la famille des RLRs, semble induire la production de cette molécule et jouer un rôle dans l’initiation de la réponse immunitaire à la suite des injections chez la souris. De l’aveu même des auteurs, les données scientifiques permettant de comprendre les mécanismes de la réponse immunitaire innée déclenchés par les nouveaux « vaccins » sont largement incomplètes et restent inexplorés.
Par ailleurs, d’après la publication de Seneff et ses co-auteurs, il semble que ces ARNm modifiés échappent non seulement aux senseurs précités (TLRs, NLRs et RLRs) mais qu’ils perturbent aussi la réponse médiée par les interférons (Seneff, S. et al. 2022). Comment et en quoi est-ce important ?
L’ARNm est modifié de telle sorte que sa longévité et la production protéique sont augmentées, notamment via les régions UTRs et l’optimisation des codons (Schoenmaker, L. et al. 2021). Or, la traduction est un processus physiologique hautement régulé et très complexe et c’est là qu’interviennent les miRNA (Zendjabil, M. et al. 2017)(Seneff, S et al. 2022). Sans entrer dans les détails, les miRNA sont des petits ARN non codants, d’une vingtaine de nucléotides, issus de l’expression du génome. Associés à d’autres protéines, elles forment un complexe multienzymatique appelé RISC (« RNA-Induced Silencing Complex ») dont le rôle principal est la répression de la traduction et la déstabilisation de l’ARNm, ce qui entraîne sa dégradation. En général, les miRNA reconnaissent les ARNm cibles au niveau des régions UTRs (Broughton, J. P. et al. 2016)(O’Brien, J. et al. 2018) ou ils peuvent agir comme des siRNA si la séquence du miRNA présente une complémentarité parfaite avec sa cible (Zendjabil, M. et al. 2017). Les miRNA sont impliqués dans la régulation post-transcriptionnelle et donc, ils permettent à la cellule d’adapter son activité en fonction des signaux qu’elle perçoit. Dans les faits, ce sont des acteurs essentiels à différents processus cellulaires comme la différenciation, la prolifération ou l’apoptose. Leurs dérégulations sont d’ailleurs associées à de nombreuses pathologies comme les cancers, le diabète ou les maladies cardiovasculaires (Zendjabil, M. et al. 2017)(O’Brien, J. et al. 2018). De manière très intéressante, les virus peuvent produire leurs propres miRNA ou moduler les miRNA de la cellule hôte afin de potentialiser leur réplication ou d’échapper au système immunitaire (Bardu, M. G. et al. 2020), notamment en inhibant la production des interférons ou en bloquant leur voie de signalisation (Ahmad, I et al. 2020).
Les miRNA sont aussi sécrétés et libérés dans le milieu extracellulaire. Ils ont été détectés dans le plasma sanguin et le sérum, le liquide céphalorachidien, la salive, le lait maternel et le colostrum, les urines, les larmes, les fluides séminales et folliculaires, etc. (O’Brien, J. et al. 2018). Plusieurs mécanismes permettent leur libération. En effet, ils peuvent être libérés en tant que complexes ribonucléiques, associés à des lipoprotéines HDL, dans des microvésicules, des corps apoptotiques – résidus de cellules mortes -, ou via des exosomes (Zendjabil, M. et al. 2017). Ce point est très important puisque la protéine Spike a été détectée dans des exosomes à la suite des injections de BNT162b2 (Pfizer) (Bansal, S. et al. 2021) ou expérimentalement, in vitro, après transfection d’un plasmide encodant la protéine Spike dans des cellules humaines mises en culture. Dans cette expérience, les exosomes contiennent la protéine Spike et des miRNA, notamment le miRNA590 qui cible un facteur de régulation de la voie des interférons de type I, l’IRF9, au niveau des cellules microgliales (Mishra, R. et Banerjea, A. C. 2021). Or, l’IRF9 est impliqué dans la transduction du signal médiée par l’IFNα, cytokine impliquée dans l’immunité antivirale, mais aussi anti-cancéreuse.
En ce qui concerne l’activité antivirale, les cellules infectées par le SARS-CoV-2 détectent la présence du virus via les PRRs, ce qui enclenche la production d’IFN de type I dont l’IFNα. Cette molécule est ensuite sécrétée et via son récepteur, l’IFNAR exprimé de façon ubiquitaire, déclenche une cascade d’activation moléculaire dans les cellules voisines bloquant la propagation du virus dans l’organisme (cf. schéma ci-dessous) (Ahmad, I. et al. 2020). En se liant à son récepteur, l’IFNα induit la phosphorylation des molécules appelées STAT1 et STAT2 qui forment un complexe moléculaire avec l’IRF9. Ce complexe est appelé ISGF3 (« IFN-stimulated gene factor 3 ») qui passe dans le noyau cellulaire et induit l’expression d’environ 150 gènes impliqués dans les processus antiviraux (Schoggins, J. W. et Rice, C. M. 2011)(Platanitis, E. et al. 2019)(Seneff, S. et al. 2022).
Bloquer la voie des interférons de type I revient donc à bloquer la réponse immunitaire antivirale. Par conséquent, les injections anti-covid peuvent potentiellement fragiliser les organismes en les rendant plus susceptibles aux infections virales.
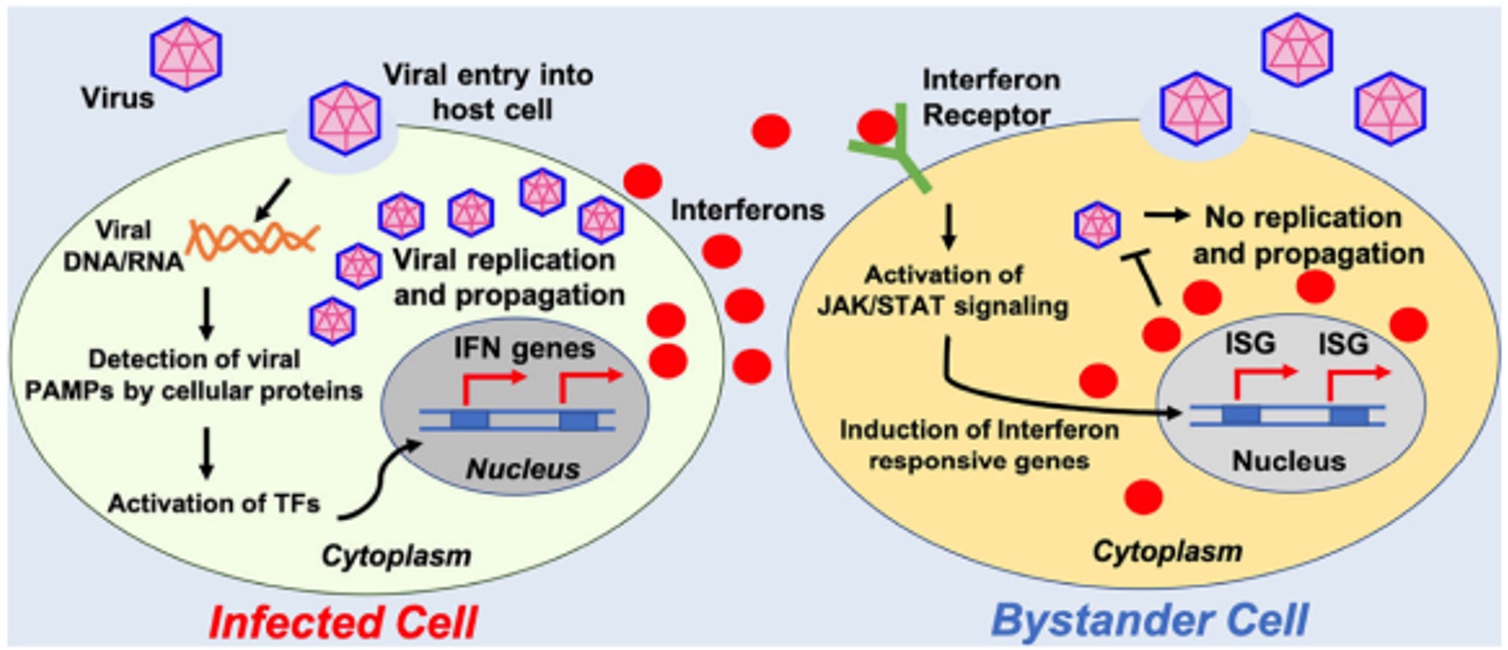
doi:10.2174/1381612826666200109181238
“Viral MicroRNAs: Interfering the Interferon Signaling”
Autre point important à évoquer : l’activité anticancéreuse des interférons de type I, et notamment de l’IFNα et du facteur de régulation IRF9. En effet, l’IFNα agit à l’encontre des cellules cancéreuses via divers mécanismes, en arrêtant le cycle cellulaire ou en induisant l’apoptose cellulaire ou en stimulant les cellules immunitaires cytotoxiques comme les LT CD8+ et les NK. L’activité antiproliférative de l’IFNα passe notamment par l’IRF9 et une dérégulation de ces deux éléments a été mise en évidence dans certains cancers comme les leucémies ou le cancer de la prostate. Ils semblent y avoir aussi des répercussions sur le gène BRCA2 impliqué dans les cancers du sein et de l’ovaire chez la femme (Seneff, S. et al. 2022).
On peut en déduire que, si les injections à ARN modifié entraînent une production de miRNA spécifiques inhibant l’IRF9 ou la voie de signalisation des interférons de type I (Mishra, R. et Banerjea, A. C. 2021), alors il y a lieu d’appréhender l’apparition de cancers dans la population (Seneff, S. et al. 2022).
Nota bene : l’optimisation des codons induit un enrichissement en guanine, G, et en cytosine, C. Cet enrichissement est potentiellement problématique puisqu’il peut entraîner la formation de quadruplex appelés pG4, ce qui peut perturber le système nerveux (Wang, E. et al. 2021). En effet, la protéine prion (PrP) possède une séquence génétique contenant de multiples motifs G4 et leur présence semble affecter la conformation de la molécule qui peut alors devenir pathogène (PrPsc) (Olsthoorn, R. C. 2014). Le fait que PrP puisse se lier à son propre ARN peut être à l’origine de cette anomalie conformationnelle. Cette observation peut soulever de nombreuses questions sachant que la protéine Spike présente des caractéristiques similaires aux prions (Seneff, S. et al. 2021). Pour information, le prion est impliqué dans une maladie neurodégénérative appelée Creutzfeld Jakob.
Pour finir cette partie, il est à noter que l’ARNm des injections anti-Covid-19, encodant la protéine Spike, présente deux codons de substitution impliquant la mise en place de 2 prolines en position 986 et 987 (Xia, Xuhua, 2021). Ce détail est important et les implications de ces substitutions seront abordés dans l’article suivant.
IV. Quel tableau immunitaire en lien avec les nanoparticules lipidiques à ARNm modifié ?
a. Quid de la distribution des nanoparticules dans l’organisme ?
Les injections de BNT162b2 (Pfizer) ou celles d’ARNm-1273 (Moderna) se font en intramusculaire. Les postulats de base des scientifiques ayant formulé ces produits reposent sur deux principes :
1. les nanoparticules lipidiques ciblent particulièrement les cellules dendritiques et cellules présentatrices d’antigènes, et
2. la distribution des nanoparticules dans l’organisme serait donc limitée, l’objectif étant essentiellement de stimuler le système immunitaire (Pardi, N. et al. 2018)(Alfagih, I. M. et al. 2020).
Dans les faits, il y a peu de données concernant la diffusion des nanoparticules dans le corps après injection dans le muscle. De récents travaux de recherche menés chez la souris ont démontré une diffusion dans le foie, la rate et le système lymphatique (Di, J. et al. 2022)(Li, C. et al. 2022). Il semble d’ailleurs que leur distribution dépende de la taille des nanoparticules (Di, J. et al. 2022)(Reichmuth, A. M. et al. 2016), ce qui est difficilement contrôlable puisque plusieurs paramètres semblent entrer en ligne de compte comme les méthodes de préparation des injections (Kudsiova, L. et al. 2021). Par ailleurs, l’ARNm contenu dans le produit Moderna a été également retrouvé dans le cerveau (Seneff, S. et Nigh, G. 2021), ce qui interpelle quand on connaît les potentielles propriétés « prion-like » mentionnées dans la partie III.
Bien que la composition des nanoparticules ne soient pas la même, certaines études montrent que les nanoparticules peuvent atteindre les ovaires (Schädlich, A. et al. 2012), ce qui pose de nombreuses questions quant à leur potentielle toxicité au niveau des appareils reproducteurs (Ajdary, M. et al. 2021). Il semble d’ailleurs que certaines formulations de nanoparticules leur permettent de franchir la barrière placentaire avec une distribution dans le foie, les poumons et les intestins des fœtus dans le modèle murin (Riley, R. S. et al. 2021). Cela soulève aussi de nombreuses interrogations quant à l’impact des injections sur les futures générations.
b. Outre le problème de la distribution, quelles sont les cellules immunitaires susceptibles d’être activées ?
Sur ce point aussi, les données sont insuffisantes. La grande majorité des publications scientifiques aborde cette problématique essentiellement au travers de l’activation des monocytes/macrophages ou des cellules dendritiques (cf. partie II). Or, les différents tissus de l’organisme possèdent des cellules immunitaires résidentes, autres que les macrophages ou les cellules dendritiques déjà présentes (Janis Kuby et al. « Immunology », 7e édition)(Breton Gaëlle, 2017). En effet, certains tissus possèdent des cellules immunitaires supplémentaires comme les mastocytes (Krystel-Whittemore, M et al. 2016), les éosinophiles (Peter F. Weller and Lisa A. Spencer 2017) ou les ILC (« Innate lymphoïd cells »)(Crinier, A. et al. 2017). Les cellules lymphoïdes innées sont des cellules immunitaires récemment découvertes qui comprennent les NK, les LTi (lymphoid tissue inducer cells) et les ILC (ILC1, ILC2 et ILC3) (Cherrier, M. 2014). Les ILC1 soutiennent la voie immunitaire Th1 et sécrètent de l’IFNγ. Les ILC2 sont plutôt en rapport avec la voie Th2 et produisent de l’IL-5 et de l’IL-13. Les ILC3 sont en lien avec la voie Th17 et produisent de l’IL-17/IL-22. Chose intéressante, les ILC3 peuvent exprimer le récepteur NCR à leur surface, ce qui leur confère un profil cytotoxique comme les NK (Moretta, A. et al. 2001)(Crinier, A. et al. 2017). Dans certaines conditions, les ILC1 peuvent aussi adopter un profil cytotoxique (Cortez, V. S. et al. 2014).
Par ailleurs, au niveau des muscles squelettiques, comme le deltoïde dans lequel on injecte les nanoparticules, les cellules mésenchymales/stromales ou MSC (aussi appelées progéniteurs fibro-adipogéniques, « fibroadipogenic progenitors » ou FAPs) semblent jouer un rôle non négligeable dans le maintien de l’homéostasie de ce tissu (Wosczyna, M. N. et al. 2019) ainsi que les ILC2 (Messing, M. et al. 2020). Or, les ILCs sont des cellules particulièrement plastiques. En effet, sous l’effet de l’IL-1β (Tahtinen, S. et al. 2022), de l’IL12 ou de l’IL-15 (Bergamaschi, C. et al. 2021), les ILC2 peuvent prendre le phénotype d’ILC1 et produire de l’IFNγ (Crinier, A. et al. 2017)(Gronke, K. et al. 2016)(Robinette, M.L. et al. 2017). Par ailleurs, il semble que l’IL-2 (Arunachalam, P. S. et al. 2021) et l’IL-7 (Bergamaschi, C. et al. 2021) permettent de différencier les ILC2 en ILC3-like chez la souris, ce qui induit la production d’IL-17. Autre élément permettant de suggérer une implication des ILC3 à la suite des injections : le recrutement des ILCPs, ou les cellules précurseurs des ILCs, vers les sites d’intérêt. En effet, les ILCPs circulent dans l’organisme. Sous l’influence de l’IL-1β et d’autres facteurs pro-inflammatoires comme les DAMPs (« Damage associated molecular patterns), les ILCPs peuvent se différencier en ILC3 et interagir avec les cellules endothéliales pour induire l’expression de molécules d’adhésion à leur surface, ce qui a pour objectif d’accroître le recrutement et l’infiltration de cellules immunitaires au niveau de la zone inflammée. De manière intéressante, l’interaction entre les ILCPs et les cellules endothéliales induit la production de cytokines pro-inflammatoires comme l’IL-6, l’IL-8, l’IFNγ et le TNF, des cytokines dont la production fut observée à la suite des injections de nanoparticules (Vanoni, G. et al. 2021)(cf. partie II).
c. Que peut-on en déduire à ce niveau ? Quelles sont les conséquences potentielles ?
Il est intéressant de signaler que l’IL-1β, l’IFNγ et le TNFα ont une activité sur les MSC (« Mesenchymal stromal cells »). Ce cocktail de cytokines induit une production d’IL-8, d’IL-6 et de MIF par ces cellules (Hackel, A. et al. 2021). Or, les MSC sont retrouvées dans la plupart des tissus de l’organisme humain, y compris dans le liquide et la membrane amniotique, l’endomètre, les saignements menstruels, le placenta et les membranes fœtales et le cordon ombilical (Ullah, I. et al. 2015). Si ces cellules possèdent des fonctions immunomodulatrices intéressantes, elles peuvent aussi adopter un phénotype pro-inflammatoire selon le contexte cytokinique si on se réfère à la bibliographie de l’article d’Alexander Hackel et de son équipe (Hackel, A. et al. 2021). Dans ce contexte, l’activation des MSC peut expliquer les troubles menstruels relevés par de nombreuses femmes à la suite des injections de NPLs.
Pareillement, les ILCs proviennent de cellules précurseurs présentes dans le foie au stade fœtal, la moelle osseuse et la rate. Après la naissance, les ILCPs se répartissent dans les organes comme les poumons, les intestins, les organes lymphoïdes secondaires et les vaisseaux sanguins périphériques. La grande majorité des tissus de l’organisme possède des ILCs, y compris dans le système nerveux central ou l’utérus (Orimo, K. et al. 2021)(Romero-Suárez, S. et al. 2019)(Doisne, J.-M. et al., 2015). D’ailleurs, les ILC3 semblent jouer un rôle majeur dans la grossesse. En effet, si ces cellules immunitaires peuvent favoriser l’implantation de l’embryon et le remodelage tissulaire, une suractivation de ces cellules peut induire de sérieuses complications (Mendes, J. et al. 2020). Pour mémoire, les ILC3 sont en lien avec la voie immunitaire Th17. Or, cette voie est particulièrement impliquée dans les troubles gestationnels. En effet, les cellules Th17 semblent être impliquées dans les fausses couches (Wang, W. et al. 2020) ou encore la prééclampsie (Laresgoiti-Servitje, E. 2013)(Eghbal-Fard, S. et al. 2019).
Par conséquent, l’activation des MSC, une potentielle distribution des nanoparticules dans les organes reproducteurs ou dans les fœtus et les données décrites ci-dessus, ensemble, soulèvent bien des interrogations quant à l’innocuité des injections chez les jeunes femmes en âge de procréer et les parturientes.
d. Quelles sont les autres données suggérant la participation d’une voie Th17 à la suite des injections de Comirnaty ou de Spikevax ? Quelles sont les processus immunitaires induits par les injections ? A quoi peut-on s’attendre ?
Bien que certains mécanismes restent obscurs, surtout en ce qui concerne l’initiation de la réponse immunitaire, les études montrent une production d’IFN-γ, de CXCL10, d’IL-15 et d’IL-12 ainsi que la synthèse de TNFα, d’IL-6, d’IL-8, d’IL-21, d’IL-1β, de CCL3 et de CCL4, notamment après les injections du produit commercialisé par Pfizer (cf. tableau partie II).
- Une voie Th1 :
L’INF-γ, l’IL-15 et l’IL-12 sont directement liés à l’activation des NK, des ILC1 et celle d’une réponse immunitaire de type Th1 (Carson, W. E. et al. 1994)(Robinette, M.L. et al. 2017)(Ivashkiv, Lionel B. 2018). De fait, de nombreuses publications scientifiques traitant de l’efficacité des produits Pfizer ou Moderna relatent l’activation des lymphocytes T CD8+, qui, pour mémoire, possèdent une activité cytotoxique (c’est-à-dire qui détruisent les cellules) et sont en lien avec la voie Th1 (Sahin, U. et al. 2020)(Oberhardt, V. et al. 2021). Les études convergent vers une réponse immunitaire à médiation cellulaire plutôt qu’humorale.
Dans ce contexte aussi, il est possible de se demander dans quels tissus les lymphocytes T cytotoxiques s’activent. En effet, dans le modèle murin, les nanoparticules lipidiques ont été détectées dans le foie (Di, J. et al. 2022). Il est alors possible que, chez l’homme, les nanoparticules puissent être endocytées par les hépatocytes, les cellules du foie, qui deviennent alors la cible des lymphocytes T CD8+ cytotoxiques et, plus largement, des effecteurs du système immunitaires. Étrangement, plusieurs publications font état d’hépatites auto-immunes après l’administration de BNT162b2, dont une montre l’infiltration de LT CD8+ dans l’organe en question (Avci, E. et Abasiyanik, F. 2021)(Boettler, T. et al. 2022)(Chen, Y. et al. 2021).
Par ailleurs, la production d’anticorps a été également mise en évidence. Cette dernière étant plutôt liée aux lymphocytes B, comment peut-on expliquer la production des anticorps ?
- Un phénomène ADCC/Th17/Th22 :
Des études montrent que les cellules transfectées produisent des DAMPs (« Damage associated molecular Pattern signals ») (Li, C. et al. 2022)(Kobiyama R. & Ishii K.J. 2022), ce qui activent les NK (Horton, N. C. et Mathew, P. A. 2015).
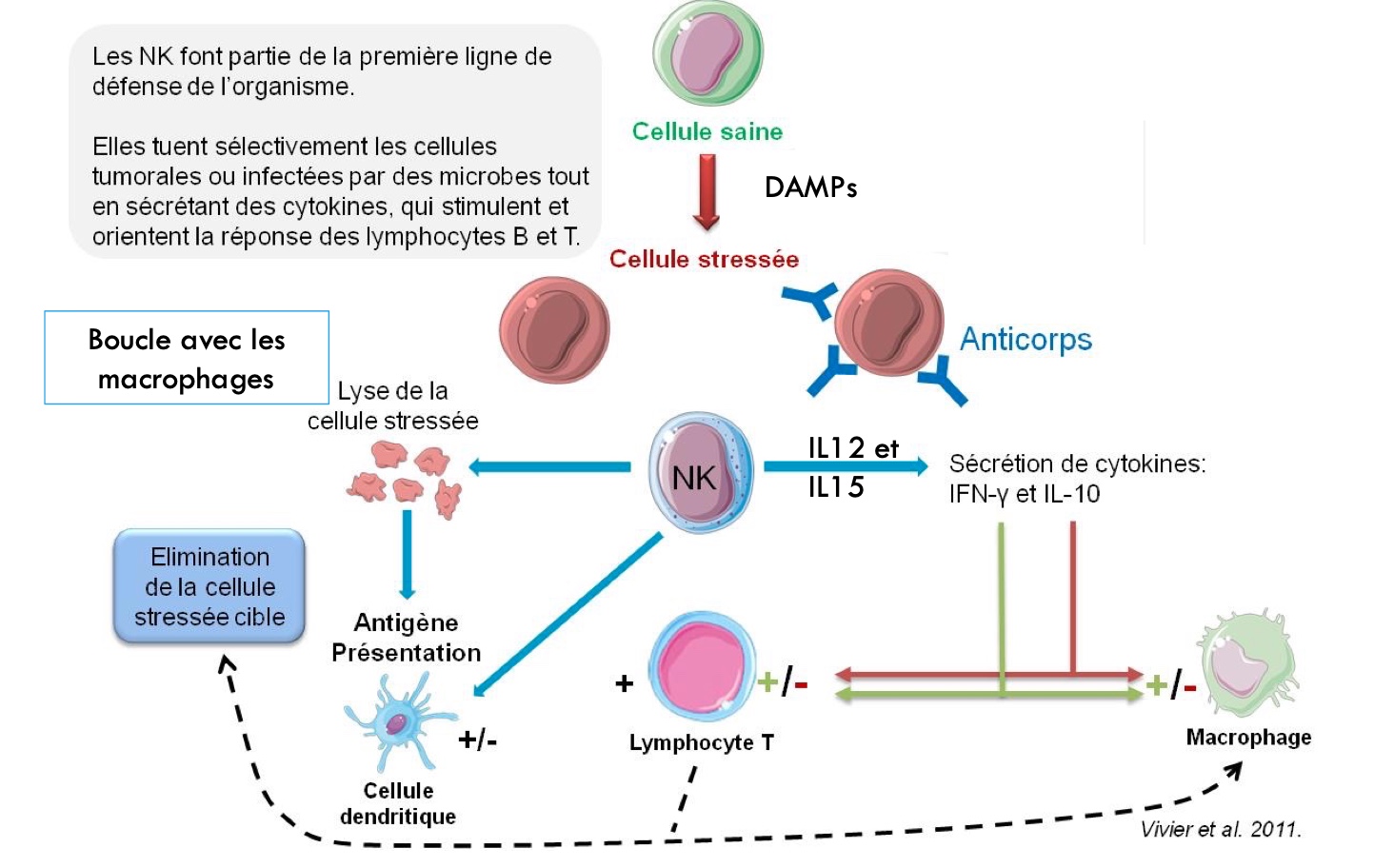
Cette activation est aussi médiée par l’IL-15, l’IL-12 et l’IL-21 (Wu, Y. et al. 2017). Par ailleurs, une publication récente fait état de l’activation des NK à la suite d’injections de BNT162b2 (Pfizer) (Hagemann, K. et al. 2022) et les cytokines produites correspondent à une activation des NK, notamment le TNFα et l’IFN-γ (Vivier, E. et al. 2011).
Une fois activés, les NK deviennent cytotoxiques et lysent les cellules pseudo-infectées par les NPLs en libérant des perforines et des granzymes. Oui, mais quelles cellules sont pseudo-infectées ? Dans quel tissu les NK vont-ils s’activer ? Il ne faut jamais oublier que les effecteurs du système immunitaire sont des cellules capables de tuer d’autres cellules, à l’instar des LT CD8+. Or, il existe des tissus ayant un faible taux de renouvellement cellulaire comme le cœur.
Par ailleurs, l’IFNγ produit par les NK attire des lymphocytes B sur le site d’intérêt. Une fois recrutés, les lymphocytes B s’activent directement au contact de l’antigène via leur BCR et se différencient en plasmocytes, sécrétant majoritairement des IgM et des IgG. Les anticorps se fixent ensuite sur les cellules cibles, facilitant ainsi leur cytolyse par les NK. Cependant, ces anticorps sont de faible affinité et les plasmocytes, de faible durée de vie (Jacob, J et al. 1991)(Bonaud Amélie, thèse de 2015)(Janis Kuby, 7ᵉ édition). Cela peut expliquer, en partie, la décroissance des taux d’anticorps dans le temps à la suite des injections et la nécessité de « booster » régulièrement l’organisme pour relancer la production d’anticorps (Leving, E. G. et al. 2021).
Autre piste intéressante à explorer : l’IL-21. Bien que peu mise en avant par Arunachalam et son équipe (Arunachalam, P.S. et al. 2021), les activités de cette cytokine sont multiples (cf. schéma ci-dessous) :
- Si elle induit la différenciation des lymphocytes B en plasmocytes, entraînant de ce fait la production d’anticorps, elle semble aussi stimuler les cellules B régulatrices (B10), cellules productrices d’IL-10 (une cytokine aux propriétés anti-inflammatoires) et, dans certaines conditions, elle déclenche l’apoptose des LB (Wu, Y. et al. 2016)(Leonard, W. J. et Wan C.-K, 2016).
- L’IL-21 peut augmenter la durée de vie des NK (Skak, K. et al. 2008).
- Elle est impliquée dans la voie Th17, si ce n’est l’induire directement (Korn, T. et al. 2007).
- Elle semble présenter une activité sur les ILC3, plutôt en réprimant la production d’IL-17A, une des cytokines de la Th17, et en stimulant l’expression de l’IL-22 (Poholek, C. H. et al. 2019).
De manière intéressante, l’IL-22 est produite par les cellules Th17, Th22, les ILCs, les NK, mais aussi par les Th1 et par les lymphocytes T CD8+ différenciés en Tc22 sous l’influence de l’IL-6 (Markota, A et al. 2018)(St-Paul, M. et al. 2020). Une voie immunitaire de type Th22 peut donc se développer à la suite des injections ? Oui, d’autant plus qu’elle peut être déclenchée par le cocktail de cytokines IL-6/TNFα (Miyazaki, Y. et al. 2018). En général, l’IL-22 est associée à la réparation des tissus. Néanmoins, son rôle reste très conversé, car cette molécule semble impliquée dans des pathologies comme la maladie de Crohn, la colite ulcérative, le psoriasis, l’arthrite rhumatoïde ou le diabète (Dudakov, J. A. et al. 2015).

“IL-21 Signaling in Immunity”
D’ailleurs, d’autres facteurs sont impliqués dans ces pathologies, notamment la Th17 et le TNFα (Cerboni, S. et al. 2020)(Jang, D.-i. et al. 2021). Prenons l’exemple du psoriasis. D’après l’équipe de Dan-in Jang (Jang, D.-i. et al. 2021), le psoriasis est une maladie chronique inflammatoire caractérisée par une hyperplasie de l’épiderme, une angiogenèse et une infiltration de leucocytes dans le derme. La pathogenèse commence par un stress des kératinocytes qui sécrètent alors du TNFα, de l’IL-1 et de l’IL-6. S’ensuit une activation des cellules dendritiques qui produisent de l’IL-12 et de l’IL-23. L’IL-12 induit une voie Th1 et l’IL-23 une voie Th17. Th1 et Th17 agissent alors en synergie : la Th1 libérant du TNFα et de l’IFNγ pendant que la Th17 produit de l’IL-17. Cette coopération cellulaire permet la production en continu de TNFα, prolongeant indéfiniment l’activation des cellules dendritiques, ce qui, finalement, permet la mise en place d’une boucle d’amplification. Le TNFα, l’IFNγ et l’IL-17 provoquent la prolifération des kératinocytes, l’épaississement de la peau (acanthose) et une kératinisation anormale des cornéocytes (parakératose).
De manière intrigante, dans une lettre à l’éditeur, des scientifiques alertent sur la recrudescence de cas de psoriasis après l’administration du BNT162b2 (Koumaki, D. et al. 2022). D’ailleurs, plusieurs articles stipulent l’observation de personnes atteintes de psoriasis après l’administration de Comirnaty (Cortonesi, G. et al. 2022)(Pesqué, D. et al. 2022)(Pavia, G. et al. 2022)(Krajewski, P.K. et al. 2021)(McMahon, D.E. et al. 2021).
Autre pathologie en lien avec le TNFα et la Th17 : l’uvéite (Jang, D.-i. et al. 2021). Dans cette pathologie, les Th1 et Th17 endommagent la barrière rétinienne, agissant sur le système vasculaire rétinien et recrutant des leucocytes. L’inflammation peut entraîner un gonflement et détruire l’uvée de l’œil, ce qui entraîne une perte de vision. Or, dans la littérature, des articles scientifiques relatent aussi des cas d’uvéite après les injections de BNT162b2 (Pfizer) (Hwang J.H. 2022)(Rabinovitch, T. et al. 2021)(Renisi, G. et al. 2021)(Duran, M. 2022).
Ces éléments suggèrent fortement qu’une voie immunitaire de type Th17 se met en place à la suite des injections de nanoparticules. Cependant, il existe une autre piste : le CXCL10. Cette molécule, retrouvée en abondance dans les publications (cf. partie II), recrute les effecteurs du système immunitaire exprimant le CXCR3 à leur surface, dont des lymphocytes Treg (Li, C. X. et al. 2016)(Kingsley, I. E. et al. 2017). Ce recrutement fut d’ailleurs observé par l’équipe d’Arunachalam. Or, les Treg produisent du TGFβ (Dat Q. Tran, 2011), qui en synergie avec l’IL-6, induit une différenciation des lymphocytes T CD4+ en Th17 (Robin D Hatton, 2011).
En quoi la voie Th17 est-elle encore inquiétante ?
Bien que les études restent controversées, la voie Th17 peut être impliquée dans la prolifération des cellules cancéreuses (Asadzadeh; Z. et al. 2017). Par exemple, les cellules Th17 semblent jouer un rôle dans l’évolution du cancer du sein (Karpisheh, V. et al. 2022). Par conséquent, le déclenchement d’une réponse immunitaire de type Th17 associé à une suppression de la voie de l’IFN par les miRNA (cf. partie III) soulève bien des questions dans le cadre des campagnes de « vaccination » de masse, notamment d’un point de vue oncologique.
e. À quelles autres conséquences peut-on s’attendre d’un point de vue immunologique ?
D’abord, l’IFN-γ et le TNFα peuvent agir en synergie pour induire un phénomène de PANoptose et donc, la mise en place d’une tempête cytokinique (Karki, R. et al., 2021). Par conséquent, les injections ne protègent pas les organismes contre l’hyper-inflammation provoquée par le SARS-CoV-2, au contraire. D’ailleurs, ce syndrome d’inflammation multisystémique induit par les injections est tout aussi dangereux que celui déclenché par le virus : « Fatal Multisystem Inflammatory Syndrome in Adult after SARS-CoV-2 Natural Infection and COVID-19 Vaccination » de Grome, H. N. et al., en 2021. Et d’autres articles traitent de ce phénomène observé aussi bien chez les adultes que chez les enfants : Stappers, S. et al.2021, Miyazato, Y. et al. 2022, Nune, A. et al. 2021, Abdelgalil, A. A. et Saeedi, F. A. 2022, Yalçinkaya, R. et al. 2022…
Ensuite, le CXCL10 est autrement problématique. Outre le fait qu’elle recrute un grand nombre de cellules immunitaires, elle est impliquée dans une dermatose particulière : la pemphigoïde bulleuse (thèse de Meriem Riani, 2017). Cette pathologie auto-immune est initiée par une cascade inflammatoire qui conduit à la production d’autoanticorps et à la sécrétion d’enzymes particulières : la MMP-9 et l’élastase. Ces deux molécules détruisent la matrice extracellulaire au niveau de la jonction dermo-épidermique (ou JDE) et sont à l’origine de la formation de la bulle à la surface de la peau. Les cellules impliquées sont les lymphocytes, les mastocytes, les neutrophiles et les éosinophiles. Or, dans le cadre des injections anti-Covid19 à ARNm, des infiltrations de neutrophiles et d’éosinophiles ont été observées chez la souris (Ndeupen, S. et al. 2021) et des cas de pemphigoïde bulleuse ont été rapportés dans la littérature (Afacan, E. et al. 2022)(Alshammari, F. et al. 2022)(Maronese, C. A. et al. 2022).
Que sait-on de l’activation des neutrophiles, éosinophiles et des mastocytes ?
Les neutrophiles sont activés par l’IL-8 (Jacobi, H.H. et al., 1998) et peuvent libérer de l’IL-6 (Barnes, T. C. et al. 2011)(Choy, E. et Rose-John, S. 2017). Outre le phénomène de NETosis et les propriétés immunosuppressives d’une sous-population de neutrophiles appelés G-MDSCs (cf. article précédent sur le SARS), une fois recrutés, les neutrophiles libèrent une panoplie d'enzymes protéolytiques comme l'élastase, les activateurs du plasminogène, la plasmine, la MMP-9 et la MMP-13, ce qui peut provoquer de sérieux dégâts tissulaires (Jing Wang, 2018).
Par ailleurs, ces cellules sont en lien avec la Th17 et elles agissent probablement en synergie dans certaines pathologies comme le lupus érythémateux (Li, Y. et al. 2019)(Pelletier, M. et al. 2009)(Wilson, A. S. et al. 2022). Pareillement, des cas de lupus ont été rapportés dans la littérature à la suite des injections anti-covid19 (Báez-Negrón, L. et Vilá, L. M. 2022)(Lemoine, C. et al. 2022).
Les éosinophiles sont aussi activées par l’IL-8 (Jacobi, H.H. et al., 1998) et par les NK (Awad, A. et al., 2014). Les éosinophiles possèdent de nombreuses fonctions immunitaires, notamment celle d’exacerber la réponse inflammatoire en libérant des cytokines ou d’autres médiateurs comme des protéines cytotoxiques (la MBP - Major Basic Protein, l’ECP - Eosinophil Cationic Protein et l’EDN - Eosinophil derived Neurotoxin). De manière très intéressante, les éosinophiles peuvent agir aussi comme les neutrophiles via un phénomène d’ « EETosis ». Si les neutrophiles peuvent libérer des NET (Neutrophils Extracellular Traps »), les éosinophiles peuvent libérer de EET (« Eosinophils Extracellular Traps ») (Lombardi, C. et al. 2022)(da Costa Silva, J. et al. 2021)(Simon, H.-U. et al. 2020). En quoi l’activation des éosinophiles est-elle potentiellement problématique ?
Comme les mastocytes, les éosinophiles sont impliqués dans les réactions allergiques (Simon, H.-U. et al. 2020)( Lombardi, C. et al. 2022) et la pemphigoïde bulleuse (Lin, L. et al. 2018). Cependant, ces cellules jouent également un rôle dans des pathologies du système cardiovasculaire comme la granulomatose avec polyangéite (ou maladie de Wegener) ou la myocardite fulminante à éosinophiles. Après vérification, des articles scientifiques relatent la survenue de ce genre de pathologies après l’administration de BNT162b2 (Pfizer) (Ameratunga, R. et al., 2022)(Costanzo, G. et al., 2022).
Pour finir, les mastocytes peuvent être recrutés et activés directement par le CXCL10 (Brightling, C. E. et al. 2005). D’ailleurs, les mastocytes comme le CXCL10 sont impliqués dans une pathologie particulière : l’asthme (Galli, S. J. et al., 2012)( Gauthier, M. et al., 2017). Les mastocytes peuvent aussi être activés par les anaphylatoxines C3a et C5a. Comment ? Les cellules présentatrices d’antigènes et les lymphocytes T produisent des facteurs B et D, connus pour activer le système du complément. Or, les lipides cationiques peuvent activer puis libérer les facteurs B et D via les CPA et les LT (Szebeni, J. et al. 2022). Si le système du complément est activé, alors il faut s’attendre à ce que les mêmes mécanismes de sensibilisation que ceux décrit dans la partie I se mettent en place.
Mieux, un autre élément suggère la mise en place d’une hypersensibilité : l’IL-9. Cette cytokine est généralement produite par les cellules Th9. Mais, elle peut être également produite par les Th17 à la suite d’une stimulation combinée de TGFβ avec, soit de l’IL-1β, soit de l’IL-6, soit de l’IL-21, soit de l’IL-23 (Van Anh Do-Thi et al., 2020). Pour mémoire, le TGFβ est potentiellement produit par les Treg recrutés par le CXCL10 et l’IL-1 β, l’IL-6 et l’IL-21 ont été identifiées chez les personnes ayant subi l’administration de Comirnaty notamment. L’IL-9 peut activer les mastocytes, les ICL2 et les lymphocytes B. Mais surtout, l’IL-9 est impliquée dans la production d’IgE (Fawaz, L. M. et al., 2007).
Conclusion
Pour résumer, la réponse immunitaire induite par les nanoparticules lipidiques à ARNm modifié est complexe.
Tout d’abord, il est à redouter la mise en place de mécanismes d’hypersensibilité, soit à l’encontre des PEGs, soit à l’encontre de la Spike. En effet, le recrutement de certaines cellules comme les éosinophiles ou les mastocytes, deux types cellulaires impliqués dans les allergies, combiné au système du complément, au CXCL10 et aux derniers éléments précités dans cet article, permettent de supposer la mise en place de phénomène allergisant à l’encontre de l’antigène viral. Dans ce cas, à chaque injection, le système immunitaire devient de plus en plus susceptible de répondre de façon incontrôlée, voire léthale.
Ensuite, le développement d’une réponse immunitaire à médiation cellulaire, plutôt orientée Th1 avec une activation des NK, peut être problématique tant que la diffusion des nanoparticules dans le corps reste non maîtrisée. D’ailleurs, le phénomène ADCC peut expliquer, du moins en partie, la diminution du taux d’anticorps dans le temps. En effet, dans ce contexte, les anticorps ne sont que des auxiliaires permettant aux NK d’exercer leur activité cytolytique plus efficacement.
Bien que les études soient plus que parcellaires, il est possible d’émettre quelques hypothèses permettant de comprendre les effets indésirables induits par les injections de nanoparticules lipidiques répertoriés dans la littérature scientifique. L’une de ces hypothèses est le déclenchement d’une voie Th17. En effet, cette voie est impliquée dans de nombreuses pathologies dont les maladies auto-immunes comme le lupus ou les maladies inflammatoires chroniques comme le psoriasis (Weaver, C. T. et al. 2013).
Le rôle des Th17 reste ambivalent dans les cancers… Néanmoins, si l’ARNm modifié de Pfizer ou de Moderna affecte la réponse médiée par les IFNs de type I via les miRNA, paralysant ainsi l’immunité anticancéreuse, le déclenchement d’une telle voie peut amplifier les phénomènes oncogènes.
Et pour finir, la voie Th17 et les ILCs sont impliquées dans les troubles gynécologiques ou ceux de la grossesse. Il est nécessaire aussi de rappeler que toutes les cellules du corps humain participent de près ou de loin à la réponse immunitaire. Et, par conséquent, il serait intéressant d’explorer l’activation des MSC à la suite des injections de BNT162b2 ou de Spikevax.
Th1, Th17 et Th22 sont trois voies immunitaires différentes, mais liées. En effet, les cellules T CD4+ peuvent adopter chacun de ces profils en fonction des cytokines présentes dans leur environnement, mais peuvent aussi changer de phénotype selon les circonstances (Jinfang Zhu, 2018), ce qui peut compliquer les investigations et les délayer dans le temps. Néanmoins, au vu des implications et des conséquences potentielles, il devient urgent de les explorer en profondeur. Ces recherches semblent lancées… En effet, récemment, une publication met évidence la présence de cellules Th17 dans les muqueuses nasales à la suite d’une injection anti-covid à ARNm (Ssemaganda, A. et al. 2022). À quand la suite ?
Toutes les références bibliographiques sont disponibles ici.
À LIRE AUSSI



L'article vous a plu ? Il a mobilisé notre rédaction qui ne vit que de vos dons.
L'information a un coût, d'autant plus que la concurrence des rédactions subventionnées impose un surcroît de rigueur et de professionnalisme.
Avec votre soutien, France-Soir continuera à proposer ses articles gratuitement car nous pensons que tout le monde doit avoir accès à une information libre et indépendante pour se forger sa propre opinion.
Vous êtes la condition sine qua non à notre existence, soutenez-nous pour que France-Soir demeure le média français qui fait s’exprimer les plus légitimes.
Si vous le pouvez, soutenez-nous mensuellement, à partir de seulement 1€. Votre impact en faveur d’une presse libre n’en sera que plus fort. Merci.

